Kanker Testis: Refarat
-
Upload
eko-maruru -
Category
Documents
-
view
81 -
download
2
Transcript of Kanker Testis: Refarat

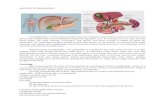
KANKER TESTIS
Pendahuluan
Kanker ktestis adalah kanker yang paling sering pada pria antara umur 20 dan
35 tahun. (Primary testicular tumors are the most common solid malignant tumor in
men between the ages of 20 and 35 years- Referensi no 1) Terdapat kira-kira 9000
kasus baru dan hanya sekitar 350 sampai 400 kematian terkait kanker testis setiap
tahun.1 (Approximately 9,000 new cases have been diagnosed in United States every
year, and only about 350 to 400 deaths have occurred annually – Referensi no 1).
Pada lebih dari 90% pasien, kanker testis dapat ditangani. Beberapa pasien dengan
massa testis solid, yang ditemukan dengan ultrasound, dianggap mengalami kanker
testis, sampai terbukti sebaliknya, dan dapat menjalani orchiecctomy radikal untuk
menegakkan diagnosis definitif. Sebelum operasi, penanda serum untuk kaker testis
dapat diambil. Dua penanda yang rutin digunakan dalam praktek klinik adalah
human chorionic gonadotropin (hCG) dan follicle-stimulating hormone (FSH).2
(For more than 90% of patients, testicular cancer is curable. Any patient with a solid testicular mass, which has been confirmed on ultrasound, is considered to have testicular cancer until proven otherwise, and should undergo a radical orchiectomy to make a definitive diagnosis. Prior to surgery, serum markers for testicular cancer should be obtained. The two markers used in routine clinical practice are human chorionic gonadotropin (hCG) and follicle-stimulating hormone (FSH – Referensi 2)
Radical orchiectomy, dilakukan dengan pendekatan inguinal daripada skrotal.
Penyebaran metastasis dari kanker testikular dapat diprediksi. Sisi metastasis primer
untuk kanker testikuler kiri dan kanan adalah berturut-turut pada nodus para-aortic
dan nodus interaortocaval pada retroperitoneum. Dranase limfatik dari skrotum,
dipihak lain, adalah nodus inguinal. Jika pada orchictomy skrotal, skrotum terlibat,
penyebaran metastasis ke nodus retroperitoneal dan inguinal mungkin terjadi. Setelah
orchiectomy untuk melokalisir sel tumor germinal, level hCG (waktu paruh 5 sampai
7 hari) dan FSH (waktu paruh 24 sampai 36 jam) yang mengalami peningkatan
sebelum operasi akan menjadi normal.1,2
1

(When performing a radical orchiectomy, the surgery should be performed by an inguinal approach rather than a scrotal approach. The metastatic spread of testicular cancer is ordered and predictable. The primary metastatic landing sites for left and right testicular cancers are the para-aortic and the interaortocaval nodes in the retroperitoneum, respectively. The lymphatic drainage of the scrotum, on the other hand, is to the inguinal nodes. If the scrotum is surgically violated by performing a scrotal orchiectomy, metastatic spread to both the retroperitoneal and the inguinal nodes becomes possible. Following an orchiectomy for localized germ cell tumor, hCG (half-life of 5 to 7 days) and FSH (half-life of 24 to 36 hours) levels that were elevated before surgery should normalize – referensi no 2)
Diagnosis kanker testis dibuat berdasarkan patologi spesimen orchiectomy. Kira-kira
95% dari kanker testis adalah germ cell tumors, sedangkan kira-kira 4% adalah
ongerm cell tumors seperti tumor Leydig cell da sel Sertoli. Germ cell tumor
selanjutnya diklasifikasikan sebagai tumor seminoma dan nonseminoma. Untuk
seminioma yang terlokalisir secara klinik, penanganan standar adalah penanganan
retroperitoneum dengan radiasi untuk mencegah rekurensi nodus, sedangkan
observasi dan follow-up tetap dilakukan. Untuk nonseminoma yang terlokalisir
secara klinik, memiliki resiko tinggi rekurensi, pilihan penanganan meliputi diseksi
limfo nodus retroperitoneal profilaksis, dua siklus kemoterapi profilaksis atau
observasi dengan follow-up sangat ketat. Pasien yang menjalani observasi harus
memahami bahwa resiko rekurensi retroperitoneal sebesar 30%. Penanganan
metastatic germ cell tumor secara umum adalah kemoterapi. Kebanyakan protokol
kemoterapi menerapkan kombinasi bleomycin, etoposide dan cis-platinum.1,2
(The diagnosis of testicular cancer is made based on the pathology of the orchiectomy specimen. Approximately 95% of testicular cancers are germ cell tumors, while approximately 4% of testicular cancers are nongerm cell tumors such as Leydig cell tumors and Sertoli cell tumors. Germ cell tumors are further classified as seminomas and nonseminomas. 45 For clinically localized seminomas, the standard of care is to treat the retroperitoneum with radiation to prevent nodal recurrence, although observation and close follow-up are also reasonable. 46 For clinically localized nonseminomas that are at high risk for recurrence, 47 the options include a prophylactic retroperitoneal lymph node dissection, two cycles of prophylactic chemotherapy or observation with very close follow-up. Patients electing observation should understand that there is a 30% risk of retroperitoneal recurrence. The treatment of metastatic germ cell tumor generally involves chemotherapy. Most chemotherapy protocols employ a combination of bleomycin, etoposide and cis-platinum – Referensi no 2)
2

Frekuensi
Kanker testis, walaupun jarang adalah keganasan yang paling sering terjadi pada pria
dengan kelompok umur 15-35 tahun dan menimbulkan banyak ketertarikan untuk
berbagai alasan. Kanker testis adalah satu dari banyak neoplasma solid yang bisa
sembuh. Perbaikan yang dramatik dalam survival yang dihasilkan dari kombinasi
teknik diagnostik yang efektif, perbaikan penanda tumor, multidrug
chemotherapeutic regimens yang efektif, dan modifikasi teknik operasi, telah
menurunkan mortalitas pasien mulai lebih dari 50% sebelum tahun 1970 menjadi
kurang dari 5% pada tahun 1997.3
Testicular cancer, although relatively rare, is the most common malignancy in men in the 15- to 35-year age group and evokes widespread interest for several reasons. Testicular cancer has become one of the most curable solid neoplasms and serves as a paradigm for the multimodal treatment of malignancies. The dramatic improvement in survival resulting from the combination of effective diagnostic techniques, improved tumor markers, effective multidrug chemotherapeutic regimens, and modifications of surgical technique has led to a decrease in patient mortality from more than 50% before 1970 to less than 5% in 1997 (Referensi 3).
Kanker testis terjadi antara 1% dan 1.5% dari neoplasma pria dan 5% dari tumor
orologi secara umum, dengan 3-6 kasus baru terjadi per 100,000 pria/per tahun di
negara barat. Peningkatan insiden kanker testis terjadi selama tahun 1970an dan
1980an, khususnya di negara Eropa Utara, dan kecenderungan peningkatan yang
jelas pada insiden kanker testis di mayoritas negara-negara industri di Amerika
Utara, Eropa dan Oceania, walaupun terdapat perbedaan yang mengejutkan dalam
angka insiden diangara negara-negara bertetangga. Data dari Surveillance
Epidemiology and End Results Program selama tahun 1973 sampai 1998
memperlihatkan peningkatan resiko yang berlanjut diantara pria Kaukasia di
Amerika Serikat sendiri, hanya untuk seminoma. Tahun 2008, sekitar 8000 pria di
Amerika Serikat didiagnosis kanker testis, dan 380 pria meninggal karenanya.
Dibandingkan pada tahun 1970an, insiden kasus meningkat sebesar 5,6 kasus per
100.000 pria, dan kulit putih memiliki insiden tertinggi 6,3 kasus per 100.000 pria.1,4,5
3

Testicular cancer represents between 1% and 1.5% of male neoplasms and 5% of urological tumours in general, with 3-10 new cases occurring per 100,000 males/per year in Western society (1-3). An increase in the incidence of testicular cancer was detected during the 1970s and 1980s, particularly in Northern European countries, and there is a clear trend towards an increased testicular cancer incidence in the last 30 years in the majority of the industrialised countries in North America, Europe and Oceania, although surprising differences in incidence rates are seen between neighbouring countries (4,5). Data from the Surveillance Epidemiology and End Results Program during the years 1973 to 1998 show a continuing increased risk among Caucasian men in the USA only for seminoma (referensi 4).
Studies published between 1980 and 2002 showed a clear trend towards an increased testicular cancer incidence in the last 30 years in the majority of industrialized countries in North America, Europe, and Oceania (Referensi 1).
In 2008, approximately 8000 men in the United States received a diagnosis of testicular cancer, and 380 men died of it. The overall incidence of testicular cancer is 5.4 cases per 100 000 men, and white men have the highest incidence, at 6.3 cases per 100 000 men (referensi 5).
Hanya 1-2% dari kasus didiagnosis bilateral. Tipe histologi bervariasi, walaupun
terlihat jelas didominasi oleh germ cell tumour (90-95%). Puncak insiden adalah
dekade ketiga kehidupan untuk nonseminoma, dan dekade keempat untuk seminoma
murni. Kluster familial telah diobservasi, khususnya diantara saudara.4
Only 1-2% of cases are bilateral at diagnosis. The histological type varies, although there is a clear predominance (90-95%) of germ cell tumours (1). Peak incidence is in the third decade of life for nonseminoma, and in the fourth decade for pure seminoma. Familial clustering has been observed, particularly among siblings (Referensi 4)
Etiologi
Penyebab pasti dari banyak kanker testikuler tidak diketahui. Namun para ahli
menemukan bahwa penyakit ini terkait dengan sejumlah kondisi lain. Sejumlah
faktor resiko telah diketahui, termasuk:6
TGCT sebelumnya pada testis kontralateral,
Cryptorchidism,
Gangguan vertilitas,
Gangguan perkembangan sex, riwayat keluarga,
4

Faktor resiko prenatal dan perinatal termasuk berat lahir, umur gestasional,
umur maternal, dan maternal merokok.
The etiology of TGCT is still unclear. A number of risk factors have been recognized, including prior TGCT in the contralateral testicle, cryptorchidism, impaired fertility, disorders of sex development, family history, and prenatal and perinatal risk factors including birth weight, gestational age, maternal age, and maternal smoking [29, 30]. Although there is some evidence for a difference in risk factors among the different histologic subtypes, the majority of risk factor analyses support a shared etiology of TGCT subtypes [29, 31] (referensi 6).
Klasifikasi
Germ cell tumor (GCT) terjadi sekitar 95% dari kanker testis. Kanker ini bisa
menunjukkan satu pola histologi yang menonjol, atau campuran dari berbagai tipe
histologi. Untuk tujuan penanganan, dua kategori luas dari tumor testis telah
diketahui yaitu: pure seminoma (tidak terdapat elemen nonseminomatous), dan
semua yang lain, yang bersama-sama dikenal sebagai nonseminomatous germ cell
tumor.1
Tabel 1— Klasifikasi tumor testis
Germ Cell Tumor
Seminoma
Klasik (khas)Tidak khasSpermatocytic
Nonseminomatous
Embryonal carcinomaTeratomaMaturImmaturMatur atau immatur dengan transformasi ganas ChoriocarcinomaYolk sac tumor (endodermal sinus tumor)
Sex Cord dan Stromal Tumor
Tumor sel Sertoli's cell tumor
5

Tumor sel Leydig Tumor sel Granular Tipe campuran (misalnya tumor Sertoli-Leydig)
Mixed Germ Cell dan elemen-elemen Stromal
Gonadoblastoma
Tumor Adnexal dan Paratesticular
Adenocarcinoma dari rete testisMesothelioma
Tumor Miscellaneous
CarcinoidLymphomaTesticular metastasis
Patogenesis
Perubahan karakteristik genetik yang ditemukan adalah isokromosom dari lengan
pendek kromosom 12 [i(12p)], yang sering terlihat pada kanker-kanker sporadik.
Diduga bahwa gen pada area ini memiliki peran penting dalam perkembangan germ
cell tumors. Sejumlah gen lain yang relatif memiliki efek yang lemah juga terlibat
dalam perkembangan kanker testis.1
Faktor-faktor genetik memiliki peran dalam perkembangan kanker testis
diperlihatkan melalui fakta bahwa resiko untuk penyakit lebih tinggi pada keluarga
urutan pertama dari pasien kanker daripada populasi umum. Kira-kira 2% dari pasien
kanker testis melaporkan memiliki keluarga yang mengalami hal yang sama. Saudara
kandung secara khusus memiliki resiko yang tinggi dengan resiko relatif 8–10.
Untuk anak laki-laki dari pasien kanker testis, resiko relatif adalah 4–6.1
Dua model karsinoma testikular in situ telah diusulkan. Fakta pertama bahwa genosit
fetal yang berkembang menjadi spermatogonia yang diblokade dapat mengalami
pembagian sel yang abnormal dan kemudian terjadi pertumbuhan invasif dan
stimulasi pubertal gonadotropin.1
6

Model postulat kedua, bahwa sel target yang paling sering untuk terjadinya
transformasi adalah zygotene-pachytene spermatocyte. Selama stadium
perkembangan germ cell, terjadi pertukaran kromatid yang dihubungkan dengan
pertukaran yang menyimpang. Normalnya, sel-sel ini mengalami eliminasi melalui
apoptosis. Pada suatu keadaan, pertukaran meyimpang ini dapat memicu peningkatan
jumlah kopian 12p dan ekspresi berlebihan dari gen cyclin D2 (CCND2). Sel-sel
pembawa abnormalitas ini relatif diproteksi terhadap kematian apoptotik oleh karena
efek onkogenik dari CCND2, hali ini memicu inisiasi ulang dari siklus sel dan
ketidak stabilan genomik.1
Transformasi malignan dari germ cells tejadi dari proses perubahan genetik dalam
berbagai langkah. Satu dari kejadian paling awal adalah peningkatan kopian jumlah
12p, apakah sebagai 1 atau lebih kopian dari i(12p) atau sebagai duplikasi tandem
dari kromosom lengan 12p. Abnormalitas ini ditemukan pada lesi karsinoma in situ
tersembunyi demikian juga pada penyakit lanjut. Studi selanjutnya menunjukkan
bahwa CCND2 ada pada pita kromosom 12p13 dan bahwa CCND2 mengalami
ekspresi berlebihan pada banyak germ cell tumor, termasuk karsinoma in situ.
Penguatan dari CCND2 mengaktivasi cdk4/6, memungkinkan sel berkembanng
melalui titik poin G1-S.1
The cause of testicular cancer is not known. The characteristic genetic change found is an isochromosome of the short arm of chromosome 12 [i(12p)], which is often seen in sporadic cancers. This suggests that genes in this region are important in the development of germ cell tumors. A number of other genes that have a relatively weak effect are also involved in the development of testicular cancer.
That genetic factors have a role in the development of testicular cancer is shown by the fact that the risk for the disease is higher in first-degree relatives of cancer patients than in the general population. About 2% of testicular cancer patients report having an affected relative. Siblings are at particularly increased risk, with a relative risk of 8–10. For sons of affected men, the relative risk is 4–6.
Two models of testicular carcinoma in situ have been proposed. The first posits that fetal gonocytes whose development into spermatogonia is blocked may undergo abnormal cell division and then invasive growth mediated by postnatal and pubertal gonadotropin stimulation.
7

The second model postulates that the most likely target cell for transformation is the zygotene-pachytene spermatocyte. During this stage of germ cell development, aberrant chromatid exchange events associated with crossing over can occur. Normally, these cells are eliminated by apoptosis. On occasion, this crossing over may lead to increased 12p copy number and overexpression of the cyclin D2 gene (CCND2). The cell carrying this abnormality is relatively protected against apoptotic death because of the oncogenic effect of CCND2, leading to re-initiation of the cell cycle and genomic instability.
Malignant transformation of germ cells is the result of a multistep process of genetic changes. One of the earliest events is the increased copy number of 12p, either as 1 or more copies of i(12p) or as tandem duplications of chromosome arm 12p. This abnormality is found in occult carcinoma in situ lesions as well as more advanced disease. Further studies indicate that CCND2 is present at chromosome band 12p13 and that CCND2 is overexpressed in most germ cell tumors, including carcinoma in situ. Amplification of CCND2 activates cdk4/6, allowing the cell to progress through the G1-S checkpoint. (referensi 1)
Diagnosis
1. Pemeriksaan Klinik
Kanker testis secara umum mempengaruhi pria muda pada dekade ketiga dan
keempat kehidupan. Normalnya terlihat sebagai massa unilateral dalam skrotum atau
massa intracrotal yang tidak nyeri, unilateral. Pada kira-kira 20% kasus, gejala
pertama adalah nyeri skrotum, dan hampir 27% pasien dengan kanker testis
mengalami nyeri lokal. Kadang-kadang, trauma pada skrotum dapat memperlihatkan
adanya massa testikuler. Gynaecomastia terlihat pada 7% kasus dan lebih sering pada
tumor non-seminomatous. Nyeri punggung dan flank terlihat pada 11% kasus.
Penurunan ukuran testis dapat mendahului tumor testis.6
Testicular cancer generally affects young men in the third or fourth decade of life. It normally appears as a painless, unilateral mass in the scrotum or the casual finding of an intrascrotal mass (30). In approximately 20% of cases, the first symptom is scrotal pain, and up to 27% of patients with testicular cancer may have local pain (1). Occasionally, trauma to the scrotum may reveal the presence of a testicular mass. Gynaecomastia appears in 7% of cases and is more common in non-seminomatous tumours. Back and flank pain are present in about 11% of cases (16). Reduction in testis size can precede a testicular tumour (31) (referensi 6).
8

Sekitar 10% kasus tumor testis dapat menyerupai orchioepididymitis, yang
menyebabkan keterlambatan diagnosis yang benar. Ultrasound dapat dilakukan pada
beberapa kasus yang meragukan. Pemeriksaan fisik menunjukkan gambaran massa
dan harus selalu dilakukan pemeriksan umum untuk menemukan kemungkinan
mestastasis jauh (supraclavicular), suatu massa abdominal yang teraba atau
gynaecomastia. Diagnosis benar harus ditegakkan pada semua pasien dengan massa
intraskrotal.6
In about 10% of cases, a testicular tumour can mimic an orchioepididymitis, with consequent delay of the correct diagnosis (1, 2). Ultrasound must be performed in any doubtful case. Physical examination reveals the features of the mass and must always be carried out in conjunction with a general examination in order to find possible (supraclavicular) distant metastases, a palpable abdominal mass or gynaecomastia. A correct diagnosis must be established in all patients with an intrascrotal mass (32).
2. Imaging pada testis
Saat ini, diagnostik ultrasound memberikan konfirmasi adanya masa testikuler dan
untuk mengeksplorasi testis kontralateral. Ulatrasound sensitif dalam mendeteksi
tumor testikuler pada hampir 100% kasus, dan memiliki peranan penting dalam
menentukan apakah massa terletak intra- atau extratesticular. Ultrasound merupakan
tes yang tidak mahal, namun tes ini tidak perlu dilakukan bila secara klinik tumor
testikuler ada. Ultrasound pada testis dapat dilakukan pada pria muda tanpa massa
testikuler yang teraba, mereka dengan massa retroperitoneal atau visceral atau
peningkatan human chorionic gonadotrophin (hCG) serum atau AFP. Ultrasound
direkomendasikan untuk follow-up testis kontralateral pada pasien beresiko.6
Magnetic resonance imaging (MRI) menawarkan sensitifitas dan spesifitas yang
lebih tinggi daripada ultrasound untuk mendiagnosis tumor dan mampu untuk
membedakan tumor seminomatous dari non-seminomatous. MRI pada scrotum
memberikan sensitifitas 100% dan spesifitas 95-100%, namun biaya untuk MRI
cukup tinggi.6,7
9

Currently, diagnostic ultrasound serves to confirm the presence of a testicular mass and to explore the contralateral testis. Its sensitivity in detecting a testicular tumour is almost 100%, and it has an important role in determining whether a mass is intra- or extratesticular (33). Ultrasound is an inexpensive test, but it is unnecessary when the presence of a testicular tumour is clinically evident (34). Ultrasound of the testis has to be performed in young men without a palpable testicular mass who have retroperitoneal or visceral masses or elevated serum human chorionic gonadotrophin (hCG) or AFP (35-38). Ultrasound is recommended in the follow-up of the contralateral testis in the follow-up of patients at risk (39).
Magnetic resonance imaging (MRI) offers higher sensitivity and specificity than ultrasound for diagnosing tumours (40-42) and may be able to differentiate seminomatous from non-seminomatous tumours. MRI of the scrotum offers a sensitivity of 100% and a specificity of 95-100% (43), but its high cost does not justify its use for diagnosis.
3. Penanda tumor serum pada diagnosis
Penanda tumor serum adalah faktor-faktor prognostik yang berkontribusi terhadap
diagnsosi dan penentuan stadium. Penanda tumor berikut ini dapat ditentukan:6
• AFP (diproduksi oleh sel yolk sac)
• hCG (ekspresi dari trophoblasts).
Lactate dehydrogenase (LDH) merupakan penanda destruksi jaringan,
direkomendasikan bagi pasien dengan penyakit metastasis. Secara global, penanda
ini meningkat pada 51% kasus kanker testis. Alphafetoprotein meningkat pada 50-
70% pasien dengan non-seminomatous germ cell tumour (NSGCT), dan peningkatan
dalam hCG terlihat pada 40-60% pasien dengan NSGCT. Sekitar 90% dari tumor
non-seminomatous terihat dengan peningkatan satu atau dua dari penanda ini.
Hampir 30% seminomas dapat muncul atau berkembang suatu peningkatan level
hCG selama rangkaian penyakit.6
LDH adalah penanda yang kurang spesifik, dan konsentrasinya sebanding dengan
volume tumor. Level LDH mungkin meningkat pada 80% pasien dengan kanker
testikuler lanjut. Perlu dicatat bahwa level penanda negatif tidak menyingkirkan
diagnosis germ cell tumour. Penanda lain yang dipelajari adalah placental alkaline
phosphatase (PLAP), yang mungkin bernilai dalam monitoring pasien dengan pure
10

seminoma. Penanda sitogenik dan molekuler tersedia di center spesifik, tapi hanya
digunakan untuk tujuan penelitian.6
Serum tumour markers are prognostic factors and contribute to diagnosis and staging (44). The following markers should be determined:
• AFP (produced by yolk sac cells)
• hCG (expression of trophoblasts).
Lactate dehydrogenase (LDH) (marker of tissue destruction) is recommended for patients with metastatic disease. Globally, there is an increase in these markers in 51% of cases of testicular cancer (16, 30). Alphafetoprotein increases in 50-70% of patients with non-seminomatous germ cell tumour (NSGCT), and a rise in hCG is seen in 40-60% of patients with NSGCT. About 90% of non-seminomatous tumours present with a rise in one or two of the markers. Up to 30% of seminomas can present or develop an elevated hCG level during the course of the disease (45, 46).
LDH is a less specific marker, and its concentration is proportional to tumour volume. Its level may be elevated in 80% of patients with advanced testicular cancer (45). It should be noted that negative marker levels do not exclude the diagnosis of a germ cell tumour. Other markers studied include placental alkaline phosphatase (PLAP), which may be of value in monitoring patients with pure seminoma. Cytogenetic and molecular markers are available in specific centres, but at present only contribute to research studies. Measurement of serum AFP, hCG and LDH (in advanced tumours) is mandatory, while that of PLAP is optional.
4. Eksplorasi Inguinal dan orchidectomy
Setiap pasien dengan dugaan massa testikuler harus menjalani eksplorasi inguinal
dengan eksteriorisasi testis didalam tunikanya. Orchidectomy segera dengan
membagi dari spermatic cord pada internal inguinal ring harus dilakukan jika tumor
ditemukan. Jika diagnosis tidak jelas, biopsi testis dilakuan untuk irisan beku untuk
pemeriksaan histologi.6
Pada kasus penyakit disseminata dan metastasis yang mengancam kehidupan,
praktek yang dilakuan saat ini mulai dengan up-front chemotherapy, dan
orchidectomy bisa ditunda sampai stabilisasi klinik terjadi.6
11

Every patient with a suspected testicular mass must undergo inguinal exploration with exteriorisation of the testis within its tunics. Immediate orchidectomy with division of the spermatic cord at the internal inguinal ring must be performed if a tumour is found. If the diagnosis is not clear, a testicular biopsy is taken for frozen section histological examination.
In cases of disseminated disease and life-threatening metastases, it is current practice to start with up-front chemotherapy, and orchidectomy may be delayed until clinical stabilisation has occurred.
5. Organ-sparing surgery
Walaupun organ-sparing surgery tidak diindikasikan pada adanya non-tumoural
contralateral testis, operasi ini dapat dilakukan pada kasus-kasus khusus yang
semuanya untuk tindakan pencegahan.6
Pada tumor testikuler bilateral synchronous, tumor etachronous contralateral, atau
pada tumor pada testis soliter dengan kadar testosteron pre-operatif normal, organ
preserving surgery dapat dilakukan bila volume tumor kurang dari 30% dari volume
testikuler dan operasi dilakukan seperti biasanya. Pada kasus lain, angka yang
berhubungan dengan Tin tinggi (setidaknya mencapai 82%), dan pada semua pasien
dapat ditangani dengan radioterapi adjuvan (20 Gy) pada beberapa titik.6,7
Infertilitas akan terjadi sesudah radioterapi dan resiko insufisiensi sel Leydig jangka
panjang sesudah radioterapi dari testis sisa meningkat. Penanganan radioterapi dapat
ditunda pada pasien fertil yang masih menginginkan anak. Pilihan harus didiskusikan
pada pasien dengan hati-hati dan operasi dilakukan di pusat yang berpengalaman.6
Although organ-sparing surgery is not indicated in the presence of non-tumoural contralateral testis, it can be attempted in special cases with all the necessary precautions.
In synchronous bilateral testicular tumours, metachronous contralateral tumours, or in a tumour in a solitary testis with normal pre-operative testosterone levels, organ preserving surgery can be performed when the tumour volume is less than 30% of the testicular volume and surgical rules are respected. In those cases, the rate of associated Tin is high (at least up to 82%), and all patients must be treated with adjuvant radiotherapy (20 Gy) at some point (47).
12

Infertility will result after radiotherapy and the risk of long-term Leydig cell insufficiency after radiotherapy of a solitary testis is increased (48). Radiation treatment may be delayed in fertile patients who wish to father children. The option must be carefully discussed with the patient and surgery performed in a centre with experience (49, 50).
6. Pemeriksaan patologik pada testis
Pemeriksaan patologik yang diperlukan:1,2
• Gambaran makroskopik: lokasi, ukuran testis, ukuran tumor maksimum dan
gambaran makroskopik dari epididimis, spermatic cord dan tunica vaginalis.
• Sampling: irisan 1 cm2 untuk tiap sentimeter dari diameter tumor maksimum,
termasuk parenkim yang terlihat normal secara makroskopik (jika ada),
albuginea dan epididimis, dengan seleksi dari area yang diduga. Pada
sekurangnya satu irisan proksimak dan satu distal dari spermatic cord
ditambah beberapa area yang diduga.
• Gambaran mikroskopik dan diagnosis: tipe histologi (menentukan komponen
individual components dan memperkirakan jumlah dalam persentase)
menurut WHO 2004:
- Ada atau tidaknya invasi venous peri-tumoural dan/atau limfatik
- Ada atau tidaknya invasi albuginea, tunica vaginalis, rete testis,
epididimis atau spermatic cord
- Ada atau tidaknya neoplasia intratubular germ cell (Tin) pada
neoplasi non-tumour parenchyma intratubular germ cell
• Kategori pT menurut Tumour Node Metastasis (TNM) 2002
• Studi imunohistokimia: pada seminoma dan mixed germ cell tumour, AFP
dan hCG.
13

Sebaiknya dilakuan pemeriksaan penanda imunohistokimia, pada kasus yang
meragukan, yaitu:6
• Pada seminoma: cytokeratin (CAM 5.2), PLAP, c-kit
• Pada intratubular germ cell neoplasia: PLAP, c-kit
• Penanda lain: chromogranine A (Cg A), Ki-1 (MIB-1).
Mandatory pathological requirements:
• Macroscopic features: side, testis size, maximum tumour size and macroscopic
features of epididymis, spermatic cord and tunica vaginalis.
6 Limited update march 2009
• Sampling: a 1 cm2 section for every centimetre of maximum tumour diameter,
including normal macroscopic parenchyma (if present), albuginea and epididymis,
with selection of suspected areas. At least one proximal and one distal section of
spermatic cord plus any suspected area.
• Microscopic features and diagnosis: histological type (specify individual
components and estimate amount as percentage) according to WHO 2004 (29):
- presence or absence of peri-tumoural venous and/or lymphatic invasion
- presence or absence of albuginea, tunica vaginalis, rete testis, epididymis or
spermatic cord Invasion
- presence or absence of intratubular germ cell neoplasia (Tin) in non-tumour
parenchyma intratubular germ cell neoplasia
• pT category according to Tumour Node Metastasis (TNM) 2002
• Immunohistochemical studies: in seminoma and mixed germ cell tumour, AFP and
hCG.
Advisable immunohistochemical markers, in cases of doubt, are:• in seminoma: cytokeratins (CAM 5.2), PLAP, c-kit• in intratubular germ cell neoplasia: PLAP, c-kit• other advisable markers: chromogranine A (Cg A), Ki-1 (MIB-1).
7. Diagnosis karsinoma in situ (Tin)
Biopsi kontralateral telah dianjurkan untuk menyingkirkan adanya Tin. Walaupun ini
merupakan kebijakan rutin dari beberapa negara, insiden Tin dan contralateral
14

metachronous testicular tumours, rendah (masing-masing 9% dan 2.5%). Masih sulit
untuk mencapai konsensus pada apakah eksistensi Tin kontralateral harus
diidentifikasi pada semua kasus. Namun, biopsi dari testis kontralateral dapat
dilakukan pada pasien resiko tinggi Tin kontralateral dengan volume testikuler
kurang dari 12 mL, riwayat cryptorchidism, atau spermatogenesis rendah (Johnson
Score 1-3). Biopsi kontralateral tidak diperlukan bagi pasien yang berumur lebih dari
40 tahun.6
Sekali Tin didiagnosis, radioterapi lokal (20 Gy dalam fraksi tunggal 2 Gy)
merupakan pilihan penanganan. Oleh karena prosedur ini dapat menyebabkan
infertilitas, pasien harus menjalani konseling hati-hati mengenai penanganan. Selain
infertilitas, fungsi sel Leydig dan produksi testosteron dapat mengalami kerusakan
jangka panjang setelah radioterapi Tin. Penanganan radiasi dapat ditunda pada pasien
fertil yang masih menginginkan anak.6,7
Contralateral biopsy has been advocated to rule out the presence of Tin (51). Although this is routine policy in some countries, the low incidence of Tin and contralateral metachronous testicular tumours (up to 9% and approximately 2.5%, respectively) (52, 53), the morbidity of Tin treatment, and the fact that most of these metachronous tumours are at a low stage at presentation make it controversial to recommend a systematic contralateral biopsy in all patients (54-56). It is still difficult to reach a consensus on whether the existence of contralateral Tin must be identified in all cases. However, biopsy of the contralateral testis should be offered to high-risk patients for contralateral Tin with a testicular volume of less than 12 mL, a history of cryptorchidism, or poor spermatogenesis (Johnson Score 1-3). A contralateral biopsy is not necessary for patients older than 40 years (57-62). A double biopsy is preferred to increase sensitivity.
Once Tin is diagnosed, local radiotherapy (20 Gy in single fractions of 2 Gy) is the treatment of choice. Because this may produce infertility, the patient must be carefully counselled before treatment commences (54, 63). In addition to infertility, Leydig cell function and testosterone production may be impaired long-term following radiotherapy for Tin (49). Radiation treatment may be delayed in fertile patients who wish to father children (59).
8. Screening
15

Walaupun tidak ada survey yang menyediakan keuntungan program screening, telah
diperlihatkan bahwa stadium dan prognosis secara langsung berhubungan dengan
diagnosis dini. Pada situasi adanya faktor resiko klinik, pemeriksaan dini individu
yang dipengaruhi, dianjurkan.6
Although there are no surveys proving the advantages of screening programmes, it has been demonstrated that stage and prognosis are directly related to early diagnosis. In the presence of clinical risk factors, selfphysical examination by the affected individual is advisable.
Penanganan
Penanganan kanker testis terdiri dari orchiectomy dan bisa melibatkan operasi lain,
terapi radiasi dan kemoterapi, tergantung pada stadium penyakit dan tipe tumor.
Melihat stadim penyakit, lebih dari 90% dari semua yang baru didiagnosis kanker
testis dapat sembuh.8,9
• Stadium pertama dari penanganan biasanya orchidectomy: mengangkat testis
yang mengalami kanker lewat insisi pada paha, dilakukan dibawah anestesi
umum.
• Penanganan selanjutnya tergantung pada diagnosis patologik (seminoma vs non-
seminoma dan stadium penyakit) dan bisa meliputi radioterapi, kemoterapi atau
observasi aktif.
– Pria dengan seminoma stadium awal, ditangani dengan radiotherapy untuk
limph nodus ipsilateral atau kemoterapi dosis tunggal.
– Pria dengan non-seminoma stadium awal biasanya menjalani pengawasan
ketat (penanda tumor, x-ray thoraks dan CT scan) jika tidak ada faktor resiko
patologik.
– Pria dengan penyakit stadium dini yang relaps dan mereka dengan penyakit
lanjut, secara umum dirujuk untuk menjalani kemoterapi. Jika kemoterapi
16

masih menyisakan massa, dan mengandung kanker, biasanya perlu operasi
pengangkatan.
• Jika pria memiliki orchidectomy bilateral (jarang), maka perlu terapi
penggantian testosteron berkelanjutan. Beberapa orang memilih untuk implan
testikuler sesudah penanganan untuk alasan kosmetik.1,2
Management of testicular cancer consists of orchiectomy and may include other surgery, radiation therapy, and chemotherapy, depending on the disease stage and tumor type. Regardless of disease stage, more than 90% of all newly diagnosed cases of testicular cancer will be cured (referensi 9).
• The first stage of treatment is usually an orchidectomy: removal of the diseased
testicle via an incision in the groin, performed under general anaesthetic
• Further treatment depends on the pathological diagnosis (seminoma vs non-seminoma and the stage of disease) and may include radiotherapy, chemotherapy or active surveillance––Men with early stage seminoma are treated with radiotherapy to the ipsilateral lymph nodes or single dose chemotherapy––Men with early stage non-seminoma usually undergo close surveillance (tumour markers, chest x-ray and CT scans) if no pathological risk factors––Men with early stage disease who relapse and men with advanced disease are generally referred for chemotherapy.
• If chemotherapy leaves residual masses, these may contain cancer and usually will need surgical removal •• If a man has a bilateral orchidectomy (rare) he will require ongoing testosterone replacement therapy. Some men choose to have a testicular implant during or after treatment for cosmetic reasons (referensi 8)
Prognosis
The International Germ Cell Consensus Classification (IGCCC), merupakan suatu
instrumen yang didasarkan pada prognosis yang mudah diaplikasikan, saat ini
digunakan dalam praktek klinik untuk klasifikasi resiko dan standar yang digunakan
saat ini untuk semua panduan praktek, termasuk National Comprehensive Cancer
Network.1
17

IGCCC membedakan pasien NSGCT dengan prognosis baik, sedang dan buruk;
dengan keseluruhan 5-year survival masing-masing 92%, 80%, dan 48%.1
Nonseminoma prognosis baik (56% sampai 61% dari nonseminomas): 5-year
progression-free survival (PFS) adalah 89%; 5-year survival sebesar 92% sampai
94%.1
Testis/retroperitoneal primer, dan
Tidak ada metastasis visceral non pulmonarius, dan
Penanda tumor serum baik; semua dari:
o Alpha-fetoprotein (AFP) kurang dari 1,000 ng/mL, dan
o Human chorionic gonadotropin (hCG) kurang dari 5,000 IU/mL
(1,000 ng/mL), dan
o Lactate dehydrogenase (LDH) kurang dari 1.5 kali per batas atas dari
normal.
Seminoma prognosis baik (90% dari seminoma): 5-year PFS adalah 82%; 5-year
survival adalah 86%
Beberapa tempat primer, dan
Tidak ada metastasis visceral nonpulmonarius, dan
AFP, beberapa hCG, beberapa LDH, normal
Nonseminoma prognosis sedang (13-28% dari nonseminoma): 5-year PFS adalah
75%; 5-year survival adalah 80% sampai 83%
Testis/retroperitoneal primer, dan
Tidak ada metastasis visceral nonpulmonarius, dan
Penanda tumor serum intermediate; beberapa dari :
18

o AFP 1,000 sampai 10,000 ng/mL, atau
o hCG 5,000 IU/L sampai 50,000 IU/L, atau
o LDH 1.5 sampai 10 kali normal.
Intermediate-prognosis seminoma (10% dari seminoma): 5-year PFS adalah 67%; 5-
year survival adalah 72%
Beberapa tempat primer, dan
Metastasis visceral nonpulmonarius, dan
AFP, beberapa hCG, beberapa LDH, normal
Poor-prognosis nonseminoma (16%–26% dari nonseminoma): 5-year PFS adalah
41%; 5-year survival adalah 71%
Mediastinal primer, atau
Metastasis visceral nonpulmonarius, atau
Penanda tumor serum buruk; beberapa dari:
o AFP lebih dari 10,000 ng/mL, atau
o hCG lebih dari 50,000 IU/mL (10,000 ng/mL), atau
o LDH lebih dari 10 kali batas atas normal.
Poor-prognosis seminoma: Tidak ada pasien seminoma yang diklasifikasikan
prognosis buruk.
The International Germ Cell Consensus Classification (IGCCC),[7] an easily applicable, clinically based prognostic instrument, is now used in clinical practice for risk classification and is the current standard for all practice guidelines, including that of the National Comprehensive Cancer Network.
The IGCCC is based on a retrospective analysis of 5,202 patients with metastatic nonseminomatous germ cell tumor (NSGCT) and 660 patients with metastatic
19

seminomatous germ cell tumors from 10 countries, who were treated between 1975 and 1990. All patients received treatment with cisplatin- or carboplatin-containing therapy as their first chemotherapy course. Median followup was 5 years. For NSGCT, independent adverse factors were identified: mediastinal primary site; degree of elevation of alpha-fetoprotein, human chorionic gonadotropin (HCG), and lactate dehydrogenase (LDH); and presence of nonpulmonary visceral metastates (NPVM), such as liver, bone, and brain. For seminoma, the predominant adverse feature was the presence of NPVM.
The IGCCC distinguishes NSGCT patients with a good, intermediate, or poor prognosis; these have reported 5-year overall survival of 92%, 80%, and 48%, respectively.
A subsequent meta-analysis of survival of patients with NSGCT, treated after 1989 and classified according to the IGCC classification, included 10 papers describing 1775 patients with NSGCT with good (n = 1087), intermediate (n = 232), or poor (n = 456) prognosis. Pooled 5-year survival estimates were 94%, 83%, and 71%, respectively. There was a small increase in survival for good-prognosis and intermediate-prognosis patients, and a large increase in survival for patients with a poor prognosis. The researchers suggested that the improved survival was most likely due to both more effective treatment strategies and more experience in treating NSGCT patients.[17]
Good-prognosis nonseminoma (56% to 61% of nonseminomas): 5-year progression-free survival (PFS) is 89%; 5-year survival is 92% to 94%
Testis/retroperitoneal primary, and No nonpulmonary visceral metastases, and
Good serum tumor markers; all of:
o Alpha-fetoprotein (AFP) less than 1,000 ng/mL, and
o Human chorionic gonadotropin (hCG) less than 5,000 IU/mL (1,000 ng/mL), and
o Lactate dehydrogenase (LDH) less than 1.5 times the upper limit of normal
Good-prognosis seminoma (90% of seminomas): 5-year PFS is 82%; 5-year survival is 86%
Any primary site, and No nonpulmonary visceral metastases, and
Normal AFP, any hCG, any LDH
Intermediate-prognosis nonseminoma (13-28% of nonseminomas): 5-year PFS is 75%; 5-year survival is 80% to 83%
20

Testis/retroperitoneal primary, and No nonpulmonary visceral metastases, and
Intermediate serum tumor markers; any of:
o AFP 1,000 to 10,000 ng/mL, or
o hCG 5,000 IU/L to 50,000 IU/L, or
o LDH 1.5 to 10 times normal
Intermediate-prognosis seminoma (10% of seminomas): 5-year PFS is 67%; 5-year survival is 72%
Any primary site, and Nonpulmonary visceral metastases, and
Normal AFP, any hCG, any LDH
Poor-prognosis nonseminoma (16%–26% of nonseminomas): 5-year PFS is 41%; 5-year survival is 71%
Mediastinal primary, or Nonpulmonary visceral metastases, or
Poor serum tumor markers; any of:
o AFP more than 10,000 ng/mL, or
o hCG more than 50,000 IU/mL (10,000 ng/mL), or
o LDH more than 10 times the upper limit of normal
Poor-prognosis seminoma: No seminoma patients are classified as poor prognosis.
21

Daftar Pustaka
1. Sachdeva K, Harris JE. Testicular cancer. Medscape refference. 2012.
2. Brunicardi FC, Andersen DK, Biliar TR, Dunn DL, Hunter JG, Pollock RE.
Testis and epiddimis. Anatomy. In: Schwartz’s. Principles of surgery. 2007;8.
3. Acosta J, Adams CA, Alarcon LH, Anaya DA, Ashley SW, Auerbach PS, et all.
Urologic malignancy. In: Townsend. Sabiston. Textbook of surgery. 2008;18.
4. Albers P, Albrecht W, Algaba F, Bokemeyer C, Cohn-Cedermark G, Fizazi K, et
all. Guidelines on testicular cancer. European Association of Urology. 2012. p
1-32.
5. Lin K, Sharangpani R. Screening for testicular cancer: an evidence review for
the US preventive services task force. Ann intern med. 2010;153:396-9.
6. Sheikine Y, Genega E, Melamed J, Lee P, Reuter PE, Ye H. Molecular genetics
of testicular germ cell tumors. Am J cancer res. 2012;2:153-167.
7. American Cancer Society. Testicular cancer. ACS. 2013.
8. Andrology Australia. Testicular cancer. Diagnosis and management. Clinical
summary guide. Monash University. 2010;6.
9. US Preventive Task Forces. Screening for Testicular Cancer: U.S. Preventive
Services Task Force Reaffirmation Recommendation Statement. Ann intern
med. 2011;154:483-6.
22