C a p í t u l o XIV HEMATOPOYÉTICOS EN …
Transcript of C a p í t u l o XIV HEMATOPOYÉTICOS EN …

561
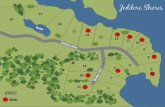
Flujograma de manejo del paciente
Desde Red PINDA RM y RegionesIngreso a Programa de TPH
Público o Privado Pacientes del Sistema Privado
¿Pacientes con Indicación TPH?
Sí
Sí
Sí
¿Requiere donante?
NO
NO
Sigue ProtocoloPINDA u otro
Sigue ProtocoloPINDA u otro
A-TPH
TPH AutólogoTPH Alogénico(90%)
Estudio HistocompatibilidadHLA
TODOS los que no son MSD,núcleo familiar incompleto
o comparten haplotipos
Donantes:- Hermano Compatible (MSD)- Familiar (fa) Compatible- No Emparentado (DnE)- Haploidéntico (Haplo)
Sólo MSD
EstudioBaja ResoluciónNúcleo Familiar
25%
EstudioAlta Resolución
75%
¿Tiene Donante?
NO
Hermano Compatible
MO, SPSCU CNT > 2,5 x 10⁷/kg
Familiar Compatible
MO y SP: 10/10 9/10SCU 6/6 - 5/6
CNT > 3 x 10⁷/kg
DnE Compatible
MO y SP: 10/10 9/10SCU 6/6 - 5/6
CNT > 3 x 10⁷/kg
Parcialmente Compatible fa DnE
MO y SP: < 9/10SCU 4/6
CNT > 5 x 10⁷/kg
TPH MSD(MO, SP, SCU)
TPH MSDfa (MO, SP, SCU)
TPH MSDDnE (MO, SP, SCU)
TPH MMD(MO, SP, SCU)
C a
p í
t u
l o X
IVTRASPLANTE DE PROGENITORES
HEMATOPOYÉTICOS EN PEDIATRÍA
Julia Palma B., Cristián Sotomayor F., Flavio Carrión A., Paula Catalán M., Jorge Morales V.,Claudia Paris D., Lucía Salas A., Paulina Salazar E., Lorena Segovia W., Paola Viveros L.

562
Guías ClínicasSociedad Chilena de Trasplante
1. introducciÓn
1.1 DescripciónyepiDemiologíaDelproblemaDesaluD
El cáncer infantil tiene una incidencia en Chile de 12-14 casos por cada 100.000 menores de 15 años y se diagnostican 500 casos nuevos por año, es la segunda causa de muerte después de los accidentes en mayores de 5 años.
Desde 1988, en el sistema público chileno de salud se desarrolló un programa de tratamiento convencional de patologías oncológicas, el programa nacional de drogas antineoplásicas (PIN-DA). Este es un grupo cooperativo nacional de pediatría oncológica que trata a todos los niños de Chile, del sistema público, con protocolos comunes. Alrededor del 90% de los niños con cáncer en Chile reciben atención médica gratuita en instituciones públicas financiadas por el estado. Este es un grupo multidisciplinario con: centros distribuidos en todo el país, tratamientos basados en protocolos internacionales probados, sólido apoyo del Ministerio de Salud, reuniones bianuales para evaluación de resultados y planificación de futuros estudios.
La tasa de curación en los años 90 era de un 65+/-5%, en Leucemia Linfoblástica Aguda (LLA) 70%, Leucemia Mieloblástica Aguda (LMA) 35%, Enfermedad de Hodgkin (EH) 83% y Tumor de Wilms 80%. (1, 2, 3,4) Si bien los resultados obtenidos eran excelentes, el grupo chileno se vio limitado por la carencia de un centro para trasplante de progenitores hematopoyéticos (TPH), procedimiento que permitiría tratar a un grupo de niños que no tienen otra posibilidad de tratamiento.
En Chile el TPH como alternativa terapéutica estaba disponible solo en el sistema privado de atención de salud. Hacia fines de la década de los 80 se realiza el primer trasplante pediátrico en Chile y se inicia el programa de trasplante pediátrico de la Pontificia Universidad Católica de Chile. (5)
En el año 1999 se desarrolló una Unidad de TPH (UTPH) Infantil Nacional en el Sistema Público en el Hospital Luis Calvo Mackenna. Este programa se desarrolló con el apoyo de entidades na-cionales e internacionales gracias al trabajo conjunto del Ministerio de Salud, Fondo Nacional de Salud, Hospital St. Jude de Memphis Estados Unidos, Hospital Luis Calvo Mackenna (HLCM), fundación de Amigos HLCM y Facultad de Medicina de la Universidad de Chile.(6)
La implementación de programas de estas características es un gran esfuerzo, tanto por el grado de complejidad que conlleva, como también por el alto costo asociado al procedimiento.
1.2 alcanceDelaguía
a. TipodepacientesyescenariosclínicosalosqueserefierelaguíaLa guía es aplicable a todos los pacientes pediátricos en los cuales el TPH podría curar la
enfermedad que motiva el trasplante o extender la expectativa de vida más allá de lo pronos-ticado por la historia natural de la enfermedad u otros tratamientos.
La guía abarca las indicaciones de trasplante; estudio pre TPH y criterios de ingreso, egreso y contraindicaciones; protocolos de acondicionamiento; complicaciones agudas, crónicas y seguimiento a largo plazo.
Se incluyeron además, criterios básicos acerca de estándares de acreditación y estructura física de UTPH.

563
Trasplante de progenitoreshematopoyéticos en pediatría
b. UsuariosalosqueestádirigidalaguíaEsta guía está dirigida a pediatras, hemato - oncólogos pediátricos, sub especialistas en
pediatría, radioterapeutas, oftalmólogos, radiólogos, enfermeras pediátricas, enfermeras on-cológicas, psicólogos, asistentes sociales, odontopediatras y otros profesionales de la salud que participan en el manejo de estos pacientes.
2. oBjetiVoS
Esta guía es una referencia para la atención de los pacientes con indicación de TPH pediá-tricos bajo el régimen de garantías explícitas.
En ese contexto, esta guía clínica tiene por objetivos:
2.1 Definir las indicaciones y contraindicaciones de TPH en pediatría
2.2 Contribuir a la estandarización de prácticas y la mejoría en la sobrevida y calidad de vida de los pacientes que son sometidos a TPH
2.3 Contribuir al uso racional de los recursos y la coordinación de las redes de presta-dores implicadas en el manejo de estos pacientes
3. recomendacioneS
3.1 requerimientosDeestructurafísicaDeutpHLas UTPH deben ser construidas o remodeladas siguiendo las guías ministeriales de plani-
ficación y diseño, publicadas y basadas en recomendaciones internacionales. (1,2)
Los datos publicados aportan evidencia que los pacientes sometidos a TPH alogénicos (Alo-TPH) deberían ser manejados en un “ambiente protector” (AP) (3) al menos hasta lograr el implante de neutrófilos y cada vez que se hospitalicen al menos hasta el día 100 post TPH o más si presenta Enfermedad de Injerto contra Huésped (EICH). Se han desarrollado múltiples guías que subrayan las necesidades particulares de los pacien-tes inmunocomprometidos y las características físicas de las unidades donde deben ser tratados.
AP se define como un área especializada de cuidados de pacientes, con flujo de aire positivo en relación con el pasillo. La combinación del uso de filtros HEPA (filtros de partículas en el aire de alta eficiencia mayor a 99%), recambios de aire mayor o igual a 12 veces por hora y mínima filtración de aire desde el exterior hacia las habitaciones, crea un ambiente seguro para pacientes que van a ser sometidos a un Alo-TPH. (3)
Las habitaciones de las UTPH deben estar selladas, no deben existir filtraciones en ventanas, puertas, enchufes, puertos de salida de oxígeno, aire u otro; los muros deben estar sellados sobre y bajo el cielo; el cielo ser liso y estucado, sin fisuras ni uniones abiertas. Un sistema de vigilancia continua debe ser implementado para detectar fugas de aire, localizarlas y repararlas. (4)
Las habitaciones deben ser individuales y contar con sistemas de ventilación que ase-guren: 1.- 12 o más recambios de aire por hora, 2.- filtros HEPA capaces de remover partículas ≥0,3 µm de diámetro, 3.- flujo de aire dirigido que entre por un extremo de la habitación y sea extraído por el opuesto, pasando el aire filtrado a través de la cama del paciente y 4.- presión positiva constante dentro de la habitación mayor a 2,5 Pascales

564
Guías ClínicasSociedad Chilena de Trasplante
en relación con pasillos, baños o antesala, adyacentes y disponer de mecanismos que controlen la diferencia de presión de manera continua.(5)
Se debe contar con sistemas de emergencia de energía y sistemas de aire redundantes (du-plicados) para mantener la presurización y el recambio de aire de la habitación cuando el sistema central de aire se apague o se le realicen mantenciones. Deben existir además protocolos bien establecidos para prevenir la diseminación de esporas de hongos cuando los sistemas de aire se reinicien, después de mantenciones de rutina. (6)
3.2 DefinicióntiposDeDonante
Los progenitores hematopoyéticos (PH) utilizados en TPH en pediatría pueden clasificarse de varias formas, 1.- según tipo de donantes en autólogos, receptor y donante son el mismo individuo y alogénicos, receptor y donantes son distintos individuos; 2.- los donantes alogéni-cos pueden clasificarse según relación genética con el receptor en donantes, hermanos (si son gemelos univitelinos se habla de donantes singénicos), familiares y no emparentados; 3.- los donantes alogénicos se clasifican además según paridad en antígenos leucocitarios humanos (HLA), ver texto más adelante; 4.- según fuente anatómica de los precursores en médula ósea, sangre de cordón umbilical o de sangre periférica movilizada; 5.- según selección celular post extracción, los injertos pueden ser no manipulados o manipulados (selección negativa de cé-lulas T depletadas o selección positiva con anticuerpos monoclonales, ej. anti CD34 o anti CD133).
La selección del donante óptimo se basa en múltiples factores como la paridad de los antíge-nos leucocitarios humanos (HLA), disponibilidad del donante, el peso y la edad del receptor, el diagnóstico de base, comorbilidades previas a TPH y el riesgo de recaída.
El factor más importante en la selección de un donante es la compatibilidad HLA. La identifi-cación de un donante HLA idéntico a nivel de ADN se considera prioritario en la actualidad. Estudios moleculares de alta resolución por ADN para la tipificación de los antígenos de HLA han identificado las diferencias entre donantes y receptores, no encontradas previamente por técnicas serológicas (1), y por tanto el estudio HLA de alta resolución a nivel de uno o mas ale-los se asocia con una reducción en la mortalidad después de un TPH de donante no emparen-tado (DnE) (2). Mientras el rol de la compatibilidad por alta resolución en HLA-A, HLA-B, y HLA-DRB1 está claramente establecido, la importancia de los otros locus, incluyendo HLA-C, HLA-DQ, HLA-DRB3 y DRB5, y HLA-DPB1 es menos clara y es motivo de investigación en la actualidad. Se ha demostrado que diferencias por alta resolución en el locus HLA-C se asocia a rechazo, EICH agudo (EICH ag) y EICH crónico (EICH cr), lo cual incide desfavorablemente en el éxito del trasplante. (3)
Algunos centros de trasplante considera 6 sobre 6 pares de locus compatible (A, B, DR), otros requieren 8 sobre 8 (A, B, C, DR), mientras que la mayoría de los centros de trasplante consi-deran actualmente 10 sobre 10 (HLA-A, -B, -C, -DRB1, y -DQB1) con estudio molecular para donante-receptor, considerándose esta como la mejor compatibilidad, especialmente en adul-tos (4–6).
Para la mayoría de los centros, una diferencia en solamente un alelo, 9 sobre 10 se consideraría aceptable. Se reporta una baja mortalidad en niños después de un TPH con una compatibili-dad a HLA de 7 sobre 10 u 8 sobre 10 con el uso de globulina antitimocítica (7). Por lo tanto, la decisión de proceder con un trasplante parcialmente compatible no emparentado debe hacer-se en el contexto de la experiencia con los regímenes de acondicionamiento, uso de células T

565
Trasplante de progenitoreshematopoyéticos en pediatría
depletadas in vivo o in vitro, régimen de profilaxis para EICH, la probabilidad de identificar el mejor donante dentro de un plazo razonable, y la disponibilidad de estrategias de trasplantes alternativos.
Con el avance en los estudios de compatibilidad HLA de DnE y las mejoras en las estrategias de tratamiento de soporte, las diferencias de los resultados entre donante hermano compatible (MSD) y DnE se hacen cada vez más pequeñas, incluso se han reportado resultados absoluta-mente comparables. (11,12)
A pesar de la disponibilidad de MSD o de DnE 10 sobre 10, las complicaciones relacionadas al trasplante, especialmente la EICH, aún sigue siendo muy importante, y nuevas investigacio-nes son necesarias para determinar los factores que influyen en el resultados de los distintos tipos de trasplante. Tales factores podrían ser antígenos menores de histocompatibilidad (13), polimorfismos genéticos de nucleótidos únicos no HLA, como por ej. Aquellos para recepto-res de citoquinas (14,15), o receptores células Natural Killer (NK). (16) Serán necesarias inves-tigaciones adicionales para determinar la influencia de estos factores en el resultado global después de un Alo-TPH.
En el caso que se disponga de más de un donante, se incluirán otros criterios de selección como: status (estado) Citomegalovirus (CMV) del donante, la edad, sexo y salud del donante y/o antecedentes sociales.
En un largo análisis retrospectivo, la influencia de varias características de los donantes fue analizada en relación a la sobrevida total (ST) y sobrevida libre de enfermedad (8). En este análisis, la edad fue el único rasgo significativo del donante asociado con la sobrevida libre de enfermedad. La tasa de sobrevida a 5 años para los receptores fue de 33%, 29%, y 25%, con do-nantes de edades entre 18 y 30 años, 31 y 45 años, y más de 45 años respectivamente (P = .0002). Un efecto similar se observó entre los casos con compatibilidad HLA parcial. Pacientes con donantes mayores tuvieron una mayor incidencia en la EICH ag y receptores con donantes femeninas que habían tenido múltiples embarazos tuvieron una tasa más alta de EICH cr. Por lo tanto, el uso de donantes más jóvenes, masculinos puede disminuir la incidencia de EICH y mejorar la sobrevida. En este análisis, la serología de CMV del donante no afectó la sobrevida ya sea de receptor seropositivo o seronegativo, y las diferencias de raza entre donante y re-ceptor tampoco afectaron los resultados. Otros estudios han demostrado una clara ventaja en la sobrevida cuando el donante y el receptor son CMV seronegativo. (9,10) Si hay posibilidad de elegir entre varios donantes HLA compatibles, un donante CMV negativo sería preferible para un paciente CMV negativo.
El donante óptimo sería un donante masculino joven quien comparta el mismo grupo de san-gre con el receptor, y con compatibilidad HLA 10 sobre 10 locus, con estudio molecular.
DefinicionesdeltipodedonantePara los objetivos de esta guía se considerarán tres tipos de donantes:
MSD: Donante Hermano HLA idéntico (matched sibling donor)
MSD genotípica o fenotípicamente idéntico
Médula Ósea (MO), Sangre Periférica (SP) o Sangre de Cordón Umbilical (SCU), Com-patibilidad en 6/6 antígenos (clase I por baja resolución y clase II por resolución inter-media), mínimamente con estudio de 2 líneas generacionales (padres y hermanos). Si tanto el donante como el receptor comparten la herencia de haplotipos claramente identificables se puede realizar el TPH. Sin embargo la recomendación actual es hacer

566
Guías ClínicasSociedad Chilena de Trasplante
HLA (de cuatro dígitos por alelo) para HLA-A, B, C DRB1 y DQB1. Para SCU de her-mano compatible, se exige además celularidad ≥ 2,5 x 107 CNT/Kg.
MD: Donante compatible
MD fa Donante familiar (no hermano) compatible
Patologías malignas: compatibilidad definida como 10/10 – 9/10 antígenos por alta re-solución.
Patologías no malignas: compatibilidad definida sólo como 10/10 antígenos por alta resolución.
MD DnE: Donante no emparentado compatible
SCU: Sangre de cordón umbilical de donante no emparentado.
Patologías malignas: compatibilidad definida como 6/6 o 5/6 antígenos por alta resolu-ción, la celularidad debe ser ≥ a 3 x 10 7 CNT/kg.
Patologías no malignas: compatibilidad definida sólo como 6/6 antígenos por alta re-solución, la celularidad debe ser ≥ a 3 x 10 7 CNT/kg.
MO o SP: Médula ósea o sangre periférico de DnE
Patologías malignas: compatibilidad definida como 10/10 – 9/10 antígenos por alta re-solución.
Patologías no malignas: compatibilidad definida sólo como 10/10 antígenos por alta resolución.
MMD: Donante parcialmente compatible (mismatch donor)
MMD Haploidéntico:
Donante familiar (habitualmente madre o padre) con los que se comparte un haplotipo definido por baja, intermedia o alta resolución, el donante se seleccionará en base a la disponibilidad y antecedentes mórbidos. La aloreactividad NK se podría considerar como criterio de selección según el protocolo en uso.
MMD SCU DnE: Sangre de cordón umbilical de DnE
Compatibilidad definida como 4/6 antígenos por alta resolución, la celularidad debe ser ≥ a 5 x 10 7 CNT/kg.
MMD DnE MO o SP: Médula ósea o sangre periférico de DnE
Compatibilidad definida como < 9/10 antígenos por alta resolución.
MMD Fa MO o SP: Médula ósea o sangre periférico de familiar
Compatibilidad definida como < 9/10 antígenos por alta resolución.
3.3 inDicacionesDetpHenpeDiatría
Introducción:Durante las últimas décadas el TPH se ha transformado en una terapia con claros beneficios
en un número creciente de patologías oncológicas y no oncológicas. El Grupo Europeo de Tras-

567
Trasplante de progenitoreshematopoyéticos en pediatría
plante de Médula (EBMT) publicó en 1996 la primera revisión de indicaciones de TPH en adulto y niños (1). Las indicaciones han sido actualizadas periódicamente (1-4).
Las indicaciones de TPH de esta guía, están basadas en las del EBMT (4), pero han sido adap-tadas de acuerdo a la realidad de nuestro país, según la disponibilidad de donante y la repre-sentatividad de nuestros grupos étnicos en los registros internacionales de donantes volunta-rios de médula ósea o sangre de cordón umbilical. Siguiendo los estándares internacionales de calidad (JACIE-FACT) el MDDnE de MO o SP no es por ahora, una opción en nuestro país; para optar a este tipo de donantes es necesaria la acreditación internacional. Por este motivo no se incluye MDDnE de MO o SP en esta guía (7).
CategorizacióndelosTrasplantes:Las indicaciones de trasplante han sido clasificadas de acuerdo a la evidencia en la litera-
tura en:
Estándar o “rutina” (E): Este tipo de trasplante puede ser realizado por un centro especializa-do con experiencia en trasplante de progenitores hematopoyéticos que tenga la infraestruc-tura adecuada (4,7).El resultado de este procedimiento debe ser superior al tratamiento de la patología sin trasplante.
Opción Terapéutica (OT): Es la definición más compleja de todas y está basada en la posibili-dad de ofrecer como arma terapéutica el trasplante. Son patologías infrecuentes, con riesgos, por la edad del paciente o por la co-morbilidad asociada, en estos casos el TPH tiene un mayor riesgo de Mortalidad Relacionada al Trasplante (MRT). En este caso es fundamental tener a un grupo de expertos para ser consultados; ellos deberán evaluar minuciosamente si el TPH está indicado y que certifique que el lugar donde se hará el trasplante cuente con la infraestructura y experiencia necesaria para lograr el mejor resultado (4).
En Desarrollo (D): Esta categoría define un grupo de patologías con poca experiencia en tras-plante, que requiere de publicaciones futuras para aclarar el rol del TPH. Estos trasplantes deberían ser realizados en pacientes que ingresen a protocolos clínicos de investigación. Estos protocolos deben ser aprobados por el Comité de Ética Local y deberán cumplir los estándares internacionales (4).
Generalmente No recomendado (GNR): Esta categoría define a un grupo en el cual el trasplan-te no es una opción de tratamiento, ya que no ofrece una mejor sobrevida y se asocia a alto riesgo de mortalidad y secuelas a largo plazo del trasplante (4).
Categorías de donante:
Ver capítulo de definición de donantes.
IndicacionesPatologíasOncológicas:(verTabla3.3.1)
Leucemiamieloideaguda(LMA):El pronóstico de LMA se ha modificado significativamente en las últimas 2 décadas, con
quimioterapia intensiva se logra su remisión entre el 80-90% y curación entre un 30-70%. El TPH con MSD en 1º Remisión Completa (RC) logra sobrevida entre un 45-65% y es actual-mente una opción terapéutica planteable sólo en los pacientes con LMA de alto riesgo. La indicación del TPH en 1RC es controvertida (4,8), sin embargo, en LMA en 2RC el TPH es la única herramienta terapéutica que ha logrado curaciones prolongadas.

568
Guías ClínicasSociedad Chilena de Trasplante
Leucemialinfoblásticaaguda(LLA):La LLA es el cáncer más frecuente en la infancia. La sobrevida libre de eventos (SLE) ha
mejorado considerablemente, por este motivo, la indicación de trasplante en LLA está redu-cida a un grupo de pacientes en 1RC con leucemia de alto riesgo, en los que la ST esperada con tratamiento convencional sea <50%. Los factores de riesgo son la presencia de uno o más de los siguientes: respuesta a tratamiento (esteroides), remisión al término de la inducción a 4 drogas, translocaciones o alteraciones citogenéticas específicas (3-4,8).
Un 20-25% de leucemias recae, de ellas, las recaídas precoces constituyen las de peor pronóstico. A pesar de lograr una segunda remisión en el 90%, muchas desarrollan una enfermedad progre-siva a corto plazo. Diversas estrategias terapéuticas como quimioterapia intensiva y TPH están siendo evaluadas. Existe clara evidencia que en LLA en recaída medular y combinada, el tras-plante con MSD es superior a la quimioterapia convencional, pero los trasplantes con donantes no relacionados están restringidos a un subgrupo de muy alto riesgo. (8)
Síndromemielodisplástico(SMD):El pronóstico del SMD en niños es desfavorable. El trasplante es la terapia de elección para
las citopenias refractarias dependientes de transfusiones con citogenética anormal; citopenias refractarias con sideroblastos en anillo dependiente de transfusiones con citogenética anor-mal; citopenia refractaria con exceso de blastos o blastos en transformación con y sin mono-somía 7 u otras alteraciones complejas como también en Leucemia mielomonocítica Juvenil (LMMJ). (1-4,8)
LeucemiaMieloideCrónica(LMC):El TPH no es el único tratamiento curativo en el niño con LMC (4,8) desde la introducción
de los inhibidores de la tirosin kinasa (TKI). Sin embargo sigue siendo una opción terapéutica en pacientes pediátricos, especialmente en aquellos con refractariedad a TKI y en fases avan-zadas de la enfermedad. La sobrevida después del trasplante oscila entre un 70-80% con MSD y 40-60% con DnE (8). La limitante de los donantes alternativos es la alta MRT, que puede variar entre un 31% en fase crónica, hasta un 49% en fase acelerada (FA) o crisis blástica (CB).
Linfomas:En niños el pronóstico de la EH y Linfomas No Hodgkin (LNH), aún en etapas avanzadas,
es favorable con quimioterapia y radioterapia. En los pacientes que tienen una recaída qui-miosensible estaría indicado el trasplante autólogo (A-TPH). La alta Mortalidad Relacionada al Trasplante (MRT) en las etapas avanzadas de la EH y LNH ha limitado la indicación del trasplante Alo- TPH) en estas patologías. (1-4)
Tumoressólidos:En Neuroblastoma, el A-TPH claramente ha demostrado ser útil principalmente en pa-
cientes en etapa IV, mayores de 18 meses y en aquellos con n-myc amplificado mayores de 1 año independiente de su etapificación. En los neuroblastomas en 2 RC el A-TPH también está indicado mejorando las posibilidades de curación hasta en un 27%.
El Retinoblastoma metastásico o > 1RC corresponde a un grupo de muy mal pronóstico, por lo que la consolidación con A-TPH está indicada.
El sarcoma de Ewing metastásico o en 2RC tiene muy mal pronóstico por lo cual está indicado el A-TPH.

569
Trasplante de progenitoreshematopoyéticos en pediatría
En otros tumores sólidos no hay indicaciones estándar. La recaída sigue siendo la causa del fracaso de esta arma terapéutica. Se requiere de estudios prospectivos en el futuro para acla-rar en qué tumores sólidos se mejoraría la sobrevida con una consolidación con megadosis y rescate con auto o Alo-TPH (1-4).
Patologías no Oncológicas: Ver Tabla N˚ 3.3.2
Hemoglobinopatías:Las hemoglobinopatías graves son extremadamente raras en Chile y la experiencia en su ma-nejo es limitada.
Los resultados con TPH han mejorado en las talasemias con el uso de la clasificación de riesgo de Pesaro y el desarrollo de los nuevos regímenes de acondicionamiento. Un TPH con MSD es el tratamiento de elección en pacientes con talasemia mayor. El uso de donantes alternativos es una opción terapéutica. (4)
El desarrollo de tratamientos de soporte exitosos han mejorado la calidad de vida de los pa-cientes con anemia a células falciformes; el TPH solo está recomendado cuando hay un MSD y no puede recibir en forma adecuada la terapia de soporte. Los resultados con trasplantes de donantes alternativos son limitados y escasos. (4)
Síndromedefallamedular: Aplasia Medular Severa (AMS): El tratamiento de primera línea es el TPH con MSD
y constituye una urgencia. La SLE es de 70-90% con TPH. En ausencia de MSD, el paciente debe recibir tratamiento inmunosupresor y realizar búsqueda de donante alternativo. Frente a falta de respuesta a la inmunosupresión, recurrencia de la enfermedad o confirmación de una mielodisplasia, se plantea TPH con donantes alternativos. (1-4)
Aplasiamedularcongénita:- Anemia de Fanconi (AF): El TPH logra curar la falla medular y prevenir la leucemi-
zación; sin embargo no previene el desarrollo de otras enfermedades malignas. La indicación de TPH se define por: plaquetas <40000/mm3, Hemoglobina (HB)<9g/dl, Recuento Absoluto de Neutrófilos (RAN): 0.5-1x10(9)/L, asociación con anomalías cro-mosómicas (monosomía 7, ganancia de 3q, anomalía del cromosoma 1) o SMD/LMA, así como el antecedente de <25 transfusiones (glóbulos rojos (GR) y/o plaquetas). Está indicado el TPH con MSD o MD. (1- 4,9).
- Blackfan Diamond (ABF): El tratamiento corticoidal constituye el tratamiento de pri-mera línea. Si el paciente evoluciona con resistencia o dependencia a corticoides, pa-ciente tiene indicación de TPH con MSD. Los donantes alternativos se plantearán sólo cuando exista además, una intolerancia a los quelantes del fierro, aloinmunización por transfusiones, citopenias bi o trilineales o evolución a LMA o SMD (1- 4).
Inmunodeficiencias: Neutropenia congénita de Kostmann: En este grupo de pacientes, la falla a la terapia
con G-CSF por resistencia y/o la presencia de la mutación del gen de la elastasa cons-tituyen indicación de TPH con MSD o MD (1-4).

570
Guías ClínicasSociedad Chilena de Trasplante
Inmunodeficiencia primaria severa (SCID): El TPH es el tratamiento de elección y constituye una urgencia, por lo que deben ser referidos inmediatamente a una UTPH. Tienen indicación de cualquier tipo de donante siendo la primera elección un MSD, luego un MD y finalmente un MMD.
EL TPH con MSD tiene una ST 90% si se realiza precozmente después del nacimiento. En caso de diagnóstico o sospecha al nacer no deben recibir vacuna BCG. En espera del TPH los pacientes deberán recibir terapia de sustitución con inmunoglobulina endovenosa y profilaxis para Pneumocystis jirovecii.
El donante haploidéntico familiar también constituye una alternativa a considerar ya que en los últimos años la sobrevida ha mejorado de un 35% a un 75% por el avance en las técnicas de manipulación del injerto. (1-4)
Wiskott-Aldrich (WAS): Requiere para su diagnóstico el cuadro clínico sugerente y la demostración de ausencia de proteína WASP. A la fecha el único tratamiento curativo es el TPH. En presencia de enfermedad confirmada y con MSD disponible, se ha re-portado sobrevida en rango: 81-88%. Aún en caso de DnE, la SLE llega a 71%, especial-mente en pacientes menores de 5 años. (10)
Erroresdelmetabolismo:
En años recientes, el TPH ha constituido una terapia efectiva en enfermedades derivadas de errores del metabolismo (SLE 80% en pacientes con enfermedad leve o asintomática). La expe-riencia publicada ha logrado demostrar el beneficio en algunas de estas enfermedades como: síndrome de Hurler, enfermedad de Krabbe y Adrenoleucodistrofia ligada al X (1-4).
En la Adrenoleucodistrofia ligada al cromosoma X, el compromiso de sistema nervioso central (SNC) moderado o severo es una contraindicación para el TPH, no regresa post trasplante e incluso puede progresar. Requiere en forma absoluta de una evaluación de SNC con un Score de Loes <5 y también de evaluaciones cognitivas y sensoriales. (11)
Osteopetrosis:
El alo-TPH con MSD logra SLE de hasta de 73% a 5 años. Con DnE solo se rescatan el 40% de los pacientes y con haploidénticos el 24%. El MDSCU es una alternativa con resultados demos-trados por Eurocord de un 50%. La falla de implante es la complicación más importante. (12)
Enfermedadesautoinmunes:
Con los resultados publicados hasta la fecha, la indicación de TPH debe ser evaluada caso a caso según diagnóstico(1-4).

571
Trasplante de progenitoreshematopoyéticos en pediatría
Tabla N°3.3.1 Indicaciones de TPH en enfermedades oncológicas en Pediatría 2009
Enfermedad RemisiónAlogénicos
AutólogosMSD MDfa MDSCU MMD
LMA RC1 (BR) GNR GNR GNR GNR GNRRC1 (AR) E OT GNR GNR ERC1 (MAR) E E E OT GNRRC2 E E E E GNR>RC2 OT D D D GNR
LLA RC1(BR) GNR GNR GNR GNR GNRRC1(AR) E E E OT GNRRC2 E E E OT OT>RC2 E E E OT OT
LMC FC E E D D GNRFA E E D D GNR
LNH RC1 (BR) GNR GNR GNR GNR GNRRC1 (AR) D D GNR GNR GNRRC2 E E OT GNR OT
EH RC1 GNR GNR GNR GNR GNR1° recaída D D GNR GNR E
SMD E E OT OT GNRTumor a células germinales GNR GNR GNR GNR DSarcoma de Ewing (AR o > RC1) D GNR GNR GNR E
Sarcoma de partes blandas (AR o >RC1) D D GNR GNR D
Neuroblastoma AR D GNR GNR GNR ENeuroblastoma >RC1 D D GNR D ETumor de Wilms > RC1 GNR GNR GNR GNR DOsteosarcoma GNR GNR GNR GNR DTumores cerebrales GNR GNR GNR GNR DRetinoblastoma RC1clase IV o V GNR GNR GNR GNR E
Retinoblastoma >RC1 GNR GNR GNR GNR EAbreviaciones: MSD: Hermano compatible, MDfa: Donante familiar compatible, MDSCU: Donante compatible de sangre de cordón umbilical de donante no emparentado, MMD: Donante parcialmente compatible, LMA: Leucemia mieloide aguda, LLA: Leucemia linfoblástica aguda, LMC: Leucemia mieloide crónica, FC: Fase crónica, FA: Fase avanzada, LNH: Linfoma no Hodgkin; EH: Enfermedad de Hodgkin, SMD: Síndrome mielodisplástico, RC 1,2,3: Remisión completa 1,2,3. E: Estándar, GNR: Generalmente no recomendado, OT: Opción terapéutica, D: En desarrollo.

572
Guías ClínicasSociedad Chilena de Trasplante
Tabla N° 3.3.2 Indicaciones de TPH en enfermedades no malignas en Pediatría 2009.
EnfermedadAlogénicos
AutólogosMSD MDfa MD SCU MMD
IDP E E E E NATalasemia E OT GNR GNR NAAnemia Falciforme (AR) E OT GNR GNR NAAAS E E OT D NAAnemia de Fanconi E E OT D NAABD E OT OT GNR NAEGC E E OT D NAN. Kostmann E E D GNR NAMPS-IH Hurler E E OT OT NAMPS-IH Hurter Scheie (severa) GNR GNR GNR GNR NAMPS-VI Maroteaux-Lamy OT OT OT OT NAOsteopetrosis E E E D NAAdrenoleucodistrofia E E E GNR NAOtras enfermedades de depósito GNR GNR GNR GNR NAEnfermedades autoinmunes GNR GNR GNR GNR DAbreviaciones: MSD: Hermano compatible, MDfa: Donante familiar compatible, MDSCU: Donante compatible de sangre de cordón umbilical de donante no emparentado, MMD: Donante parcialmente compatible, OT: Opción terapéutica, RC1, 2,3: Remisión completa 1,2,3. D: En desarrollo, GNR: Generalmente no recomendado NA: No aplicable, E: Estándar, AR: Alto riesgo, IDP: Inmunodeficiencia primaria, AAS: Anemia aplásica severa, ABD: Anemia de Blackfan Diamond, EGC: Enfermedad granulomatosa crónica, N: Neutropenia, MPS: Mucopolisacaridosis.
3.4 evaluaciónpretpH,criteriosDe ingreso, exclusión,contrainDicacionesingresoalprogramaDetpH
CriteriosdeingresoparapacientesdelsistemapúblicoPara los pacientes beneficiarios del sistema y tratados en protocolos del PINDA, la indica-
ción debe estar incluida dentro de las indicaciones de TPH-PINDA:
• Patología oncológica: antes de los 15 años o menores de 25 años que recaigan
• Patología no oncológica: menores de 15 años
• Incluir resumen actualizado, solicitud de derivación, informe social e informe psicológico.
CriteriosdeexclusióndelProgramadeTPH(Receptor)(3)• Enfermedad progresiva
• No contar con donante disponible
• Pacientes embarazadas o en lactancia
• Pacientes con patologías concomitantes que puedan afectar su sobrevida independiente-mente de la patología por la que se indica el trasplante
• Rechazo del trasplante por parte del paciente o la familia
• Pacientes con situación psicosocial incompatible con el procedimiento

573
Trasplante de progenitoreshematopoyéticos en pediatría
Seleccióndeldonante(3),(4)Estudio HLA resolución intermedia/alta: al grupo familiar (paciente, hermanos y padres).
El donante seleccionado debe tener pase de Banco de sangre. Consentimiento Informado acep-tado y firmado por el donante o sus padres si es menor de edad y Asentimiento Informado si es mayor de 12 años. Si existe más de un donante HLA idéntico, hay que considerar algunas características de estos para hacer la elección del donante:
• Edad: Elegir al más joven
• Sexo: Idealmente evitar una donante mujer para un receptor varón
• Transfusiones: Idealmente sin antecedentes de transfusiones
• Embarazos: Idealmente sin embarazos previos
• Serología CMV: Idealmente positivo si el receptor es CMV positivo
• Grupo sanguíneo: Idealmente iso grupo con el receptor
• Familiar/No emparentado: Donante familiar
Contraindicaciones para la donación de progenitores hematopoyéticos (2), (3)• Serología VIH positiva o SIDA
• Hepatitis vírica activa
• Serología Virus hepatitis C positiva y/o Antígeno de superficie virus hepatitis B positivo
• Asma que requiere tratamiento
• Antecedentes de enfermedades cerebro vasculares, trombosis arterial o trombosis venosa, hemofilia o enfermedad de Von Willebrand
• Enfermedad de Creutzfeld-Jacob
• Diabetes mellitus insulinodependiente
• Hipertensión arterial no controlada
• Abuso de drogas
• Antecedentes de enfermedad tumoral maligna
• Toxoplasmosis y toxocariasis: tratar la infección parasitaria previo a la donación
• Piercing y tatuajes: se debe esperar 1 año para la donación
• Embarazo (1 año después del parto), lactancia (una vez terminada)
• Cualquier condición que suponga un alto riesgo quirúrgico para el donante.
Criteriosparaactivareltrasplante(1)La enfermedad de base y el status de la remisión del paciente son los indicadores más im-
portantes de la probabilidad de éxito del TPH y de la sobrevida libre de evento a largo plazo.
• En pacientes con patología oncológica, confirmar que se encuentra en remisión completa de su enfermedad
• El estudio de remisión no debe tener más de un mes de antigüedad
• En pacientes con patología no oncológica, según status clínico y disponibilidad de donante.

574
Guías ClínicasSociedad Chilena de Trasplante
Activacióndeltrasplante(1)El paciente que va a recibir un TPH requiere ser sometido a una minuciosa evaluación
clínica, además de la orientación y consejo por parte de médicos, enfermeras y asistente social del centro de trasplante. Toda la información en relación al tratamiento previo recibido, inclu-yendo estudios del diagnóstico inicial, drogas recibidas y tratamiento con radioterapia.
Primeraentrevistaconelequipodetrasplante(1),(3)• Historia clínica, examinar al paciente, revisar los resultados de los exámenes tomados al
momento del diagnóstico
• Chequear tipaje HLA del paciente y posible donante (si Alo-TPH)
• Revisar resultados de exámenes que confirman la remisión
• Programar revaloración del estado actual de la enfermedad si existen dudas o si ha pasado más de un mes de ésta.
• Informar al paciente y su familia en relación al tipo de trasplante al cual va a ser sometido, sus potenciales complicaciones, el resultado esperado, tratamientos alternativos, lista de espera y demora previsible.
• Entregar al paciente y familia una copia del Consentimiento Informado y/o Asentimiento. Se debiera citar nuevamente, después de unos días, para darle tiempo de analizar la situa-ción.
Segundaentrevistaconelequipodetrasplante(1)• Chequear resultados de exámenes que confirman remisión
• Aclarar dudas del paciente y familia en relación al procedimiento
• Firmar Consentimiento Informado y/o Asentimiento
• Programar evaluación pre trasplante del receptor y/o donante.
Evaluaciónpretrasplantedonantey/oreceptor(3,4)Una vez confirmado que el paciente se encuentra en remisión completa y se ha firmado el
Consentimiento Informado y/o el Asentimiento, tanto el donante (si Alo-TPH) como el recep-tor son sometidos a una nueva evaluación clínica. Este proceso permite minimizar los riesgos del donante durante el proceso de donación de progenitores hematopoyéticos y evaluar si el receptor está en condiciones de ser sometido al trasplante. (Tabla 3.4.1).
Criteriosdeelegibilidaddelpacientepostevaluaciónpretrasplante(1,3,5)• Fracción de acortamiento > a 25%
• Clearence de creatinina > a 40 cc/L,73 m2
• Capacidad funcional vital forzada > a 40% de la predicha u oximetría de pulso > 92% con oxigeno ambiental
• Indice de Karnofsky > 70% (Tabla 3.4.2) y/o un índice de Lansky ≥ a 60% (Tabla 3.4.3)
• Bilirrubina < a 3,0 mg/dL y transaminasas menores a 500 U/L
• Creatininemia < al doble del valor normal para la edad
• El paciente no debe presentar enfermedad mental severa

575
Trasplante de progenitoreshematopoyéticos en pediatría
• El paciente no debe presentar otras enfermedades graves concomitantes
• El paciente debe estar libre de enfermedad infecciosa activa
• El paciente debe ser VIH negativo
Tabla 3.4.1: Evaluación pre trasplante donante / receptorSerologías virales y parasitarias Toxoplasmosis – ELFA IgG
Elisa Toxocara canis IgGElisa enfermedad de Chagas (IgG)CMV(IgG e IgM)Virus Epstein Barr (VEB) (IgG e IgM)Virus herpes simplex tipo I y II (IgG e IgM)
Virus Hepatitis A (IgM)Anticuerpos totales Virus Hepatitis BAnticore virus hepatitis BVirus Hepatitis CVDRLVIHVirus humano asociado a linfoma T (HTLV)
Estudio hematológico HemogramaPruebas de coagulaciónGrupo sanguíneo AB0 y Rh
Perfil bioquímico Electrolitos plasmáticos, Gases venososCreatinina plasmática, Nitrógeno ureico, Acido úricoTransaminasa Glutámico Oxalacética (GOT),Transaminasa Glutámico-Pirúviva (GPT),Gamma Glutamil Transferasa (GGT)Deshidrogenasa Láctica (LDH)Fosfatasas alcalinas, Bilirrubina total y directaGlicemia, Calcio ,Fósforo, Magnesemia
Evaluación estado inmunológico Inmunoglobulina G, A, MSubpoblaciones linfocitarias Sólo receptorBlastogénesis
Otros Quimerismo pre trasplante (sólo en alo trasplante)Cross – match (sólo al donante y receptor TPH haploidéntico)Sub unidad beta (donante y receptor si corresponde)Orina completa
Monitorización microbiológica Determinación antígeno aspergillusPCR cualitativa Adenovirus (ADV) Sólo receptor TPH PCR cualitativa VEB donante alternativo PCR cualitativa CMV
Evaluación cardiorespiratoria Electrocardiograma, Ecocardiograma (sólo al receptor)Radiografía tórax, Tomografía Axial Computada (TAC) según correspondaEspirometría (sólo al receptor)
Evaluación por especialistas Evaluación dental (sólo al receptor), Evaluación nutricionalEvaluación medicina transfusional, Evaluación anestésica Estudio del ambiente social, Estudio psicológicoEvaluación por médico de adulto (cuando el donante es adulto)

576
Guías ClínicasSociedad Chilena de Trasplante
Tabla 3.4.2: Escala de rendimiento de Karnofsky
Nivel de actividad (pacientes ≥ 17 años) Calificación (%)
Normal, no presenta signos o síntomas de la enfermedad 100Capaz de llevar a cabo actividad normal; signos y síntomas leves 90Actividad normal con esfuerzo, algunos signos o síntomas de enfermedad 80Capaz de cuidarse, pero incapaz de llevar a cabo actividad normal, o trabajo activo 70Requiere atención ocasional, sin embargo, puede cuidarse de la mayoría de sus necesi-dades
60
Requiere asistencia y frecuentes cuidados médicos 50Encamado, necesita cuidado y atenciones especiales 40Invalidez severa, con indicación de hospitalizar 30Inválido grave, necesita hospitalización y tratamiento general de soporte 20Muy grave, rápida progresión de la enfermedad 10Muerte 0
Tabla 3.4.3: Escala de Lansky
Nivel de actividad (pacientes menores de 16 años) Calificación (%)
Plenamente activo 100Limitación mínima en actividades físicas extenuantes 90Activo, pero se cansa más rápidamente en juegos extenuantes 80Juega menos o dedica menos tiempo a juegos activos con asistencia y supervisión 70Encamado hasta 50% del día, muy pocos juegos activos con asistencia y supervisión 60Precisa considerablemente asistencia para cualquier juego activo; es capaz de participar en juegos reposados
50
Pasa la mayor parte del día en la cama; capaz de iniciar actividades reposadas 40Frecuentemente dormido; precisa notable ayuda para realizar actividades reposadas 30No juega; no se levanta de la cama; participación pasiva (mirar TV, etc.) 20No responde a estímulos 10Exitus 0

577
Trasplante de progenitoreshematopoyéticos en pediatría
3.5 obtención De progenitores Hematopoyéticos: méDula osea, sangreperiférica,sangreDecorDónumbilical
Las 3 fuentes fundamentales de progenitores hematopoyéticos que se describen en esta guía son:
1. Progenitores hematopoyéticos de médula ósea (PHMO).
2. Progenitores hematopoyéticos en sangre periférica (PHSP) que se refiere a la recolección por aféresis.
3. Progenitores hematopoyéticos de sangre de cordón umbilical (PHSCU).
Estas guías también se aplican a productos como Células para terapia celular (TC) e infusiones de linfocitos T (DLI) (1).
Objetivos:
Garantizar la seguridad del donante o paciente durante el procedimiento.
Obtener una cifra de células en la recolección que asegure un adecuado implante y éxito en el procedimiento (2).
PolíticasyProcedimientos- Estas deben incluir todos los aspectos tales como la selección del donante, asentimiento y
consentimiento informado, test microbiológicos, recolección, etiquetado, procesamiento, almacenamiento, transporte, manejo y mejoramiento de la calidad, análisis de resultados, procedimientos de seguridad, limpieza, entrenamiento del personal, mantención de los equipos, criterios para liberación, etc.
- El director médico y el director de laboratorio deben revisar y aprobar todas las políticas y procedimientos anualmente (1).
RequerimientosdeSeguridad- Cada instalación donde se recolectan y procesan los PH deben operar de manera de mini-
mizar los riesgos para la salud del personal, donantes y pacientes. (1)
InstalacionesparalaRecolección:- PHMO, PHSP, PHSCU Y TC, deben ser recolectados en una instalación del Hospital o
Clínica, ya sea pabellón o en la unidad de aféresis que cumplan con estándares mínimos. (1,3)
- La unidad recolectora debe estar a cargo de un Director Médico, que debe ser un médico con experiencia en Trasplante o en aféresis y un director Técnico, que debe ser un tecnólo-go médico con entrenamiento y experiencia en aféresis y recolecciones en general. Además se debe contar con un número adecuado de personal capacitado para la realización de los procedimientos. (1)
EtapaspreviasalaObtenciónPHMOyPHSP- Evaluación por el equipo de Trasplante del paciente o donante.
- El donante o paciente debe tener los estudios pre trasplante realizados (ver estudio pre TPH en está guía), y no poseer contraindicaciones generales para la realización del proce-dimiento. (2,4)

578
Guías ClínicasSociedad Chilena de Trasplante
- Se deberá realizar una entrevista de selección a los donantes por personal del banco de sangre, de acuerdo a los requisitos nacionales e internacionales. (4)
- El donante o paciente debe firmar consentimiento informado sobre el procedimiento, si éste es menor de edad deberá ser firmado por sus padres o en sus efectos por el represen-tante legal. (1,2, 3, 4)
En el caso de la recolección de PHMO, se debe realizar además una evaluación anestésica en donde además se revisará la necesidad de utilizar la hemodilución aguda normo-hiper-volémica, para evitar la transfusión heteróloga.
- Se deberá administrar Fe oral (5 mg/kg/día, en forma de sal ferrosa) desde 1 mes antes de la extracción hasta 1 mes después (5).
- La cantidad de médula a extraer será determinada por el siguiente criterio:
Si el donante tiene un peso > al peso del receptor, se recolecta 20 mL/Kg (del peso del donante)
Si el donante tiene un peso < al peso del receptor, se recolecta arribas de 30 mL/Kg (del peso del donante), siempre y cuando esto no provoque un deterioro no esperado en el donante.
- El médico del equipo de trasplante será el responsable de la revisión final y documen-tación del los datos del donante previo a la recolección como:
Resultados de laboratorio
Examen físico
- Además deberá verificar que en el pabellón estén los materiales necesarios para la recolec-ción. (2)
ObtencióndelosProgenitoresPHMO- El procedimiento se realiza en pabellón bajo anestesia general, utilizando técnica aséptica.
- Se realiza en espina iliaca postero-superior a través de punciones múltiple realizadas con agujas especiales para el procedimiento.
- En cada extracción se debe aspirar un máximo de 2 mL para evitar la contaminación con sangre periférica.
- La médula ósea recolectada se debe depositar en un kit de recolección, especialmente dise-ñado y comercializado para esos fines (Fenwall Collection and transfer bags). (2)
- Se deberá usar solución anticoagulante que debe contener heparina (1000 UL/mL) sin conser-vantes más plasmalyte, en una proporción de 2000 UI heparina mas 100 mL de plasmalyte.(2) Se puede usar 10 mL de ACD (citrato) más 2 mL de heparina o sea 2000 UI. (5)
- Una vez finalizada la recolección el producto deberá ser filtrado a través de 2 filtros in-cluidos en el kit, el primero de 500 micrones y el segundo de 200 micrones, a una bolsa recolectora. (2)
AnálisisdelProducto- Se debe tomar al producto muestra para recuentos celulares, CD34+, células nucleadas
totales (CNT), células mononucleares (CMN), viabilidad, cultivo de células formadoras de colonias (CFU-GM) y cultivo bacteriológico. (1, 6)

579
Trasplante de progenitoreshematopoyéticos en pediatría
CuidadospostRecoleccióndelDonante- Después que la recolección es completada el donante debe ser transferido a la sala de recu-
peración.
- El médico del equipo de trasplante de médula ósea, y que realizó la recolección, debe com-pletar la hoja de operación.
- Una vez que el anestesista así lo considere el donante es retornado a la unidad en donde se encontraba hospitalizado. (2)
En el caso de los PHSP deberá hacerse una evaluación por el personal de aféresis de los acce-sos venosos.
- En el caso de los donantes los accesos venosos periféricos podrían ser usados.
- Si las vías periféricas no fueran adecuadas en los donantes y en el caso de niños pequeños, se debe considerar la postura de un catéter venoso central.
- La postura del catéter central debe ser sólo hecha en dependencias del hospital, con acceso a Unidad de cuidados intensivos y unidad de radiología, y por personal altamente entre-nado y que regularmente realice este procedimiento.
- Personal que realiza la recolección deberá asegurarse del correcto funcionamiento de la vía central (1).
ObtencióndelosProgenitoresPHSP- El día de inicio de la recolección dependerá del régimen de movilización utilizado.
Existen distintos regímenes de movilización como:
Factor estimulador de colonias granulocíticas (G-CSF) 10-15 ug/kg/día, usado en donantes y pacientes.
Ciclofosfamida + G-CSF, usado en pacientes.
Quimioterapia + G-CSF, usado en pacientes. (5, 7, 8)
- Idealmente el paciente debe tener leucocitos mayores a 5000 × mm3, plaquetas mayores a 50000 × mm3 y HB ≥ 9 g/dL. (6)
- El recuento de CD34+ es el mejor predictor del resultado de la recolección el cual se moni-toriza hasta alcanzar valores ≥15 células CD34+/µL. (7)
- Se debe utilizar en pacientes pediátricos idealmente una máquina de aféresis de flujo con-tinuo.
- Se debe realizar una aféresis de grandes volúmenes (+ de 3 volemias totales sanguíneas). (6)
- En el caso de los pacientes de < de 25 kilos en donde el volumen extracorpóreo de la má-quina excede el 15% de la volemia del paciente o si el cálculo del hematocrito durante el procedimiento disminuye mucho se deberá evaluar la posibilidad de cebar la máquina con glóbulos rojos filtrados, irradiados y compatibles con el paciente. (9).
- Se deberá tomar exámenes de control previos al procedimientos y posterior al procedi-miento. De ser necesario durante el procedimiento en pacientes muy pequeños o con algu-na otra complicación. Los exámenes recomendados son: (9,10,11)
Calcio iónico, Magnesio, Sodio, Potasio, Glicemia, Recuento de plaquetas, Hematocrito.

580
Guías ClínicasSociedad Chilena de Trasplante
- Si una aféresis no es suficiente, ésta deberá ser repetida al día siguiente para lo cual el pa-ciente deberá seguir recibiendo el factor.
AnálisisdelProducto- Una vez finalizado el procedimiento de aféresis se debe tomar muestra de la bolsa de
recolección para cultivo bacteriológico, Viabilidad, CMN, CNT, CD34 y cultivo de células formadoras de colonias (CFU-GM). (1,6)
ObtencióndePHSCU
CriteriosdeInclusión- Mujeres con historia obstétrica normal
- Ausencia de antecedentes médicos maternos o paternos que supongan un riesgo de trans-misión de enfermedades infecciosas o genéticas a través de la SCU.
- Desarrollo del parto con normalidad
- Consentimiento informado firmado por la madre
Criteriosdeexclusiónpropiosdelparto- Duración de la gestación menos de 32 semanas
- Amniorrexis mayor a 12 horas
- Fiebre materna mayor a 38ºC
- Inmunización feto-materna
- Anemia materna severa
- Signos de sufrimiento fetal
ConsentimientoInformado- Todas las madres que cumplan con los criterios de inclusión deberán ser informadas antes
del parto de interés terapéutico de la sangre de cordón umbilical, del procedimiento de donación y de los posibles riesgos para la madre y el niño. El consentimiento debe ser por escrito y debe cubrir los siguientes aspectos:
- Se hará una historia clínica familiar y personal sobre el riesgo de enfermedades infecciosas o genéticas,
- Se efectuarán determinaciones serológicas para marcadores de enfermedades infecciosas a la madre y cultivo de la SCU.
- En la visita post natal se repetirán las serologías virales y se realizará un examen físico al recién nacido.
- En el caso que los controles serológicos o las características del volumen y celularidad de la SCU no fueran adecuadas deberá ser eliminada.
Recolección- Cuando la recolección es realizada “in útero” se deberá proteger la seguridad de la madre
y el niño.

581
Trasplante de progenitoreshematopoyéticos en pediatría
- Las recolecciones “in útero” sólo debieran realizarse en partos sin complicaciones.
- Para recolecciones alogénicas o autólogas, la decisión de recolectar a infantes con menos de 34 semanas de gestación debe ser basada en una evaluación de la seguridad del recién nacido, por el obstetra a cargo del paciente. (3,12)
Estudios Necesarios
- Volumen
- Células nucleadas totales
- Células mononucleares
- CD34+
- CFU-GM
- Tipaje HLA
- Grupo sanguíneo
- Serologías virales:
o Antígeno de superficie virus hepatitis B
o Virus hepatitis C
o VIH 1 y 2
o CMV
o HTLV1 y 2
o Toxoplasma
o VEB
o Chagas
- Cultivos microbiológicos
Seguimiento- Entre 120 y 180 días después del parto deberá controlarse a la madre y el niño:
- Se repetirán las serologías virales a la madre
- Se practicará un examen sistemático al niño dirigido a buscar enfermedades infecciosas y genéticas transmisibles.
CriteriosdeeliminacióndelaUnidaddeSCU- Volumen de la unidad menor a 60 mL
- Células totales menores a 4 × 108
- Serologías maternas positivas
Cultivos microbiológicos positivos (según germen) (3,12).

582
Guías ClínicasSociedad Chilena de Trasplante
3.6 aconDicionamientoEl acondicionamiento o régimen de acondicionamiento corresponde a la etapa terapéutica
previa a la infusión de progenitores hematopoyéticos; es una combinación de radioterapia, quimioterapia, tratamiento inmunosupresor y tratamientos de profilaxis de complicaciones, cuyos objetivos son:
1) Lograr el control de la potencial enfermedad residual.
2) “Crear espacio” para que se alojen los progenitores infundidos.
3) Lograr una adecuada inmunosupresión que impida el rechazo de los progenitores infun-didos.
El acondicionamiento ideal es aquel que logra eliminar en su totalidad las células malignas del huésped, con una baja morbi-mortalidad, y que permite suficiente inmunosupresión para prevenir la falla de implante y la EICH. En la actualidad, no existe ningún acondicionamiento que cumpla con este ideal (1,2).
Los regímenes de acondicionamientos han cambiando a la luz de los efectos adversos que se han hecho evidentes en el tiempo. Los factores a considerar al momento de diseñar un régimen de acondicionamiento son múltiples; los más importantes son: Tipo de trasplante, tipo de patología (oncológica y no oncológica), disparidad HLA, edad del receptor, fuente de progenitores hematopoyéticos (MO, SP, SCU), efectos adversos, MRT y efectos tardíos (ej. crecimiento y endocrino) (1-3).
Los PH sanos o leucémicos son altamente sensibles a la radiación; esta fue la primera herra-mienta utilizada para el acondicionamiento. La irradiación corporal total (ICT) en dosis de 10 a 14 Grays (Gy), tiene un buen efecto antitumoral con llegada a gónadas y sistema nervioso central y adecuado efecto inmunosupresor, sin embargo es una técnica compleja que requiere personal e instalaciones sofisticadas. La ICT presenta múltiples efectos adversos, especialmen-te en la población pediátrica por ejemplo: Enfermedad crónica pulmonar, leucoencefalopatías, cataratas, segundos cánceres, trastornos endocrinos y de fertilidad. Debe evitarse en niños pequeños y está contraindicada en niños menores de 2 años. La toxicidad de ICT depende de la dosis total, la frecuencia de exposición y la dosis por exposición. Las estrategias para dis-minuir la toxicidad incluyen escudos para limitar radiación de tejidos más sensibles, fraccio-namiento (dividir la dosis total en 5 a 6 fracciones de 2 Gy en dos exposiciones diarias) y uso de irradiación nodal total (menor efecto antitumoral manteniendo efecto inmunosupresor). La tendencia actual y futura, es reducir y eventualmente eliminar la radioterapia y sustituirla por quimioterapia de acción equivalente. La ICT sola, es suficiente para que se produzca el implante pero insuficiente para lograr el control de la enfermedad a largo plazo por lo que es necesario asociarla a quimioterapia (1-3).
La quimioterapia tiene principalmente efecto antitumoral pero algunas drogas además tienen efecto inmunosupresor (ver Tabla N°3.6.1). Las drogas más frecuentemente asociadas a ICT son ciclofosfamida (Cy) y etopósido (VP-16). Otros citostáticos que se utilizan son Citarabina (ARA-C), Melfalan (MEL), Tiotepa (TT) y Fludarabina (Flu). En Alo-TPH acondicionados sin ICT, se utiliza habitualmente Busulfan (Bu); en A-TPH se utilizan combinaciones de drogas efectivas contra los tumores específicos por ejemplo Carmustina (BCNU), VP-16, ARA-C y MEL en linfomas.
Las estrategias de inmunosupresión son muy variables. Las herramientas disponibles inclu-yen anticuerpos policlonales como timoglobulinas (ATG) y monoclonales como Rituximab, Campath y otros, fármacos anticalcineurínicos (ciclosporina, tacrolimus), inhibidores del re-

583
Trasplante de progenitoreshematopoyéticos en pediatría
ceptor mTOR (sirolimus), inhibidor de síntesis de purinas linfocitarias (micofenolato), antime-tabolitos (metotrexato) y corticoides (ver tabla N°3.6.1). Estos fármacos pueden usarse en com-binación o como monoterapia. Habitualmente su uso se inicia durante el acondicionamiento y se mantiene posteriormente como profilaxis de EICH ver 3.7.
Las profilaxis de complicaciones se comentan en 3.8.
Se denominan acondicionamientos mieloablativos a aquellos que basan su efecto en qui-mioerapia y radioterapia intensas; corresponden a la estrategia tradicional en TPH, son efec-tivos pero con efectos adversos por toxicidad frecuentes; más del 50% de los pacientes pediá-tricos. Los acondicionamientos no mieloablativos (llamados también de intensidad reducida o baja intensidad) utilizan quimioterapia y/o radioterapia de menor intensidad para disminuir la toxicidad y efectos adversos y una potente inmunosupresión que permita el implante de los progenitores infundidos; por ejemplo la combinación de Flu, MEL, Bu (en dosis bajas) o ICT (2Gy) con o sin ATG. Los efectos deseados se completan por acción citotóxica de los linfocitos alogénicos. Al comienzo fueron aplicados en los adultos mayores o en pacientes con múltiples co-morbilidades que no permitían un acondicionamiento mieloablativo, en la actualidad se encuentran también en uso en pediatría.
Los regímenes de acondicionamiento más utilizados en pediatría por patología, se resumen en tabla 3.6.2
Tabla N° 3.6.1 Drogas antineoplásicas utilizadas en AcondicionamientoDroga Mecanismo de acción Dosificación Efecto Adverso Administración
Ciclofosfamida AlquilanteInterfiere en síntesis de ADN
50mg/kg a 60mg/kg/díapresentación IV: 1gr/50ml
Cistitis hemorrágica, mucositis, cardiotoxicidad, convulsiones, daño pulmonar, daño endotelial
En SF, solución de 4 a 40 mg/ml, infusión 1-3h requiere pH urinario 8.0 e hiperhidratación
Busulfan AlquilanteInterfiere en síntesis de ADN
4mg/kg/dia VOpresentación VO: comprimidos 2mg
Convulsiones, vómitos, mucositis, cardiotoxicidad, daño pulmonar
Usar fármaco anticonvulsivo 48h antes de inicio de terapia
Melfalan AlquilanteInterfiere en síntesis de ADN
70mg/m2
presentación IV: 50mg/10mL
Mucositis, insuficiencia renal aguda, cardiotoxicidad, convulsiones, daño pulmonar, daño endotelial
En S.F. solución de 0.45-2mg/mLestabilidad 1,5h en solucióninfusión 1hrequiere pH urinario 8.0 e hiperhidratación
Thiotepa AlquilanteInterfiere en síntesis de ADN
10mg/kg/díapresentación IV: 15mg/1.5mL
Mucositis, insuficiencia renal aguda, cardiotoxicidad, convulsiones, daño pulmonar, daño endotelial
En S.F. solución de 1-5mg/mlestabilidad 24h en solucióninfusión 1 hrequiere pH urinario 8.0 e hiperhidratación.eliminación dérmica: cambiar ropa de paciente 2 o más veces al día

584
Guías ClínicasSociedad Chilena de Trasplante
Carboplatino Intercalador de compuesto de platino Interfiere en síntesis de ADN
500mg/m2 utilizar fórmula de Calvertpresentación IV: 450mg/45mL
Nefrotoxicidad, alteraciones electrolíticas, otoxicidad, neuropatía periférica, hipotensión, anafilaxia
En SG5% solución 0.5-2mg/mLestabilidad 24h en solución evitar Cloruro por formación de Cisplatino.estimular diuresis con Manitol
Etopósido Polisorbato
Inhibidor de Topoisomerasa II
60mg/kg/día, presentación IV: 100mg/5mL
Hipotensión, anafilaxia, hepatotoxicidad, broncoespasmo
En SF solución 0.4mg/mLestabilidad 24h en solucióninfusión ≥4h
Citarabina Inhibe la ADN polimerasa.
3grs/m2
presentación IV: 500mg/5mL
Cardiotoxicidad, hepatotoxicidad, fiebre, anafilaxia, retinitis química, daño pulmonar
En SF solución 10-100mg/mLestabilidad 48h en solucióninfusión 2-3 husar corticoide ocular
Fludarabina Inhibe: ADN polimerasaADN ligasa ADN primasa ARN reductasa
30-40mg/m2 díapresentación IV: 50mg/2mL≥ 90mg/m2/día, mayor riesgo de convulsión, monitorizar función renal.
Neurotoxicidad, convulsiones, hepatotoxicidad, nefrotoxicidad, edema cardiotoxicidad
En SF solución 1mg/mLestabilidad 24h en solución infusión 1hhiperhidratación
Rituximab Anticuerpo monoclonal anti CD20Citotóxicidad sobre precursor de Linfocito B
375mg/m2 díapresentación IV: 500mg/50mL 100mg/10mL
Anafilaxia, hipotensión, fiebre, broncoespasmo, hiperglicemia, insuficiencia renal aguda
En SF solución 1-4mg/mLestabilidad 24h en solución infusión ≥4h requiere premedicación
Timoglobulina de Fresenius
Anticuerpos policlonales anti linfocito TCitotóxicidad sobre linfocito T
3mg/kg díapresentación IV: 25mg/5mL
Anafilaxia, hipotensión, hipertensión, fiebre, broncoespasmo, hiperkalemia, dolor abdominal
En SF hasta volumen total 300 a 500 ccrequiere premedicación
Timoglobulina de Sangstat
Anticuerpos policlonales anti linfocito TCitotóxicidad sobre linfocito T
20mg/kg día presentación IV: 100mg/5mL
Anafilaxia hipotensión hipertensión, fiebre, broncoespasmo, hiperkalemia, dolor abdominal, aumento de transaminasas
En SF solución 0.5-2mg/mLestabilidad 48h en solución. requiere premedicación
Alemtuzumab Anticuerpo monoclonal anti CD52Citotóxicidad sobre linfocito T y Buso experimental
30mg/día, 3 veces a la semana hasta 12 semanasDosis máximas: 30mg/dia 90mg/semanalesAjustar dosis por toxicidad hematológica
Hipersensibilidad anafilaxia, hipotensión, toxicidad hematológica, infecciones, sepsis, broncoespamo
En SF hasta volumen total 100mLinfusión 2hrequiere premedicación
Abreviaciones: SF: solución fisiológica; SG5% : solución glucosada al 5%, VO: vía oral, EV: vía endovenosa h: hora u horas

585
Trasplante de progenitoreshematopoyéticos en pediatría
Tabla 3.6.2 Regímenes de acondicionamiento en pediatría según patologíaEnfermedad AcondicionamientosLeucemias(LLA, LMA, LMC)
Cy/ICT± ATGBu/Cy ± ATGCy/VP-16/ICT± ATGBu/Cy/VP-16± ATGMEL/ICTARA-C/ICTVP-16/ICTCy/ATG/ICTTT/Cy/ATG/ICTTT/MEL/Flu/INT/ATG u OKT3
LNH y EH Cy/ICTBu/CyBEAM
SMD Bu/Cy/VP-16Bu/VP-16Bu/Cy/MELFlu/TT/ATGCy/ICT
Neuroblastoma Bu/MELMELMEL/ICT
Retinoblastoma Carboplatino/TT/VP-16Otros tumores sólidos Cy/Fluda/ATG
Carboplatino/VP-16/CyInmunodeficiencias Bu/Cy
Bu/Cy/ATG Hemoglobinopatía(Talasemia y Anemia Falciforme)
Bu/CyBu/Cy/MELBu/Cy/FluBu/Cy/TTBu/Cy/ATG o Alemtuzumab
AAS Cy/ATGCyCy/ICTCy/INTFalla medular congénita
(AF y ABD) Cy/INTCy/FluCy/ATG/ICT
Errores congénitos del metabolismo Bu/CyBu/Cy/Flu Bu/Cy/ATGBu/Cy/VP-16
Enfermedades de depósito Bu/CyBu/Cy/ATG
Enfermedades autoinmunes Bu/CyBu/CyCyCy/ATG/ICT

586
Guías ClínicasSociedad Chilena de Trasplante
3.7 manejoDelaenfermeDaDinjertoversusHuéspeD
La EICH constituye una complicación frecuente, mediada por linfocitos T inmunocom-petentes del injerto (fase I-II-III: figura 3.7.1). Se reconocen la EICH ag y la EICH cr. Tradicio-nalmente se ha utilizado la temporalidad para definir una u otra, siendo los 100 días el corte establecido (1); sin embargo, esta división no es absoluta y se describe EICH ag más allá de los 100 días y un síndrome con manifestaciones de EICH ag y EICH cr independiente del tiempo llamado síndrome de overlap o sobreposición.
• EICHaguda:La EICH ag se manifiesta con compromiso de piel (eritema máculo-papular, prurito, en su
forma grave, bulas y descamación), hígado (hiperbilirrubinemia, ictericia colestásica) y tubo digestivo (diarrea, dolor, íleo, anorexia). La graduación se ha establecido de acuerdo a criterios de Filipovich, modificados (2), con score final combinando los tres sistemas involucrados. (3, 4) Con menos frecuencia se ha descrito el compromiso de otros sistemas (anemia, trombocito-penia, conjuntivitis, fotofobia). (Tablas 3.7.1 y 3.7.2)
El tratamiento de primera línea se basa en corticoides (metilprednisolona, prednisona) en do-sis de 2 mg/kg/día. Dosis mayores no han demostrado efectividad estadísticamente signifi-cativa. (5) La falla del tratamiento se ha definido como: 1.- progresión a 72h de corticoides, 2.- ausencia de cambios clínicos y bioquímicos a 7 días, 3.- respuesta incompleta a 14 días de terapia corticoidal. Ante el fracaso de este tratamiento se ha publicado el uso de ATG, anti-cuerpos monoclonales (infliximab, daclizumab, etanercept), pentostatina, sirolimus, terapia celular con células mesenquemáticas, corticoterapia no absorbible en caso de EICH digestiva (6, 7).
• EICHcrónicaLa EICH cr se ha reportado en el 30-70% de pacientes adultos y pediátricos más allá del
día+100. Se presenta principalmente entre los 4 y 6 meses post-trasplante, sin embargo entre el 5-10% lo hace después del año. La clínica sugerente de EICH cr incluye esclerosis, liquen plano, es-tenosis esofágica, fasceítis, úlceras orales, atrofia, onicodistrofia, síndrome sicca. El compromiso más frecuente se describe en piel, boca, hígado, ojos. En forma menos frecuente incluye pulmón (Bronquiolitis obliterante con neumonía en organización (BOOP), neumonía idiopática), esófa-go, tracto genito-urinario, sistema osteo-articular siendo descrito como el “gran simulador” con considerable impacto en la calidad de vida de los pacientes. (8, 9). Ver tabla 3.7.3
El tratamiento local es la primera línea, excepto en casos de compromiso de 3 o más órganos, extensión mayor a score 2 en los cuales se requiere terapia sistémica. Corticoides en dosis de 1 mg/kg/día es el tratamiento de inicio, el uso asociado de inhibidores de calcineurina no ha demostrado un quiebre significativo en la recuperación de estos pacientes. La falla de tratamiento o estabilización de síntomas requiere terapia de segunda y tercera línea (MMF, sirolimus, inhibidores de calcineurina, corticoides en dosis altas, fotoféresis extracorpórea, Rituximab, talidomida, pentostatina, ATG, azatioprina, etanercept, infliximab, lidocaína, cé-lulas mesenquimáticas). En casos de EICH cr en terapia inmunosupresora es fundamental el tratamiento de soporte en base a profilaxis para Pneumocystis jiroveii y bacterias capsuladas, así como reactivación virus varicela zoster. (10, 11)
• PrevenciónLas estrategias de prevención de EICH se han modificado considerando el acceso a donan-
tes alternativos. Clásicamente se ha utilizado terapia inmunosupresora siendo la ciclosporina

587
Trasplante de progenitoreshematopoyéticos en pediatría
la droga más indicada en profilaxis de EICH. Las dosis se han evaluado, existiendo estudios que recomiendan esquemas de 1-3 mg/kg/día.(12) El uso asociado de Metotrexato (MTX) en pauta corta, días +1, +3, +6, +11 post TPH, constituye el protocolo E para ciertos grupos. El MMF se ha introducido en reemplazo de MTX para evitar los riesgos de toxicidad, retraso del implante, mucositis. (13) La depleción de linfocitos T (DLT) es otra estrategia: in vivo y ex vivo, en particular para donantes alternativos. Globulina antitimocito (ATG) en adultos ha demostrado reducción de EICH ag y cr, retiro precoz de terapia inmunosupresora, pero hace necesario el seguimiento estricto considerando la incidencia de infecciones virales y fúngicas y el retraso de la inmunoreconstitución (14). El régimen de intensidad reducida se ha asocia-do a menor incidencia de EICH y menor toxicidad, sin embargo, es necesario aún definir el tipo y tiempo de inmunosupresión, DLT, el uso y frecuencia de infusiones de linfocitos del donante.
Los fármacos utilizados en EICH se resumen en la Tabla 3.7.4.
Figura N°3.7.1 Fisiopatología del EICH
Fase I: Producto de la acción del acondicionamiento sobre los tejidos del receptor se libera sustancias pro-inflama-torias como factor de necrosis tumoral alpha (TNF-α), Interleuquina-1 (IL-1), Interleuquina 6 (IL-6) y la traslocación desde el lumen del intestino de lipopolisacáridos bacterianos (LPS). Estas moléculas activan a las células presenta-doras de antígenos (a) como las células dendríticas quienes expresan en su superficie antígenos propios del receptor (b). Fase II: Las células presentadoras de antígenos exponen antígenos (Ag) propios del receptor mediante el com-plejo mayor de histocompatibilidad (MCH). Después de la infusión de progenitores, los linfocitos T del donante (LT) entran en contacto con las células presentadoras de antígeno activadas mediante el receptor de linfocitos T (TCR). Esta interacción más la presencia de una segunda señal (2da Señal) activante, resulta en la activación de los LT contra antígenos propios del receptor. Los LT liberan citoquinas como Interferon gamma (INF-γ) e interleuquina-2 (IL-2) que amplifican la respuesta citotóxica. Fase III: Los LT sensibilizados y las células NK tienen un efecto citotóxico sobre los tejidos del receptor que expresen los antígenos expuestos inicialmente por las células presentadoras de antígenos; produciéndose así la Enfermedad del Injerto versus el Huésped.

588
Guías ClínicasSociedad Chilena de Trasplante
Tabla N° 3.7.1: Clasificación de EICH aguda según Seattle Gluksberg Modificado,Criterios de Consenso
Estado Órgano afectado
Piel Hígado Intestino
1 Rash <25% Bilirrubinemia 2 a 2,9 mg/dL
Diarrea 10cc/Kg/día o nauseas persistentes
2 Rash 25 a 50% Bilirrubinemia 3 a 6 mg/dLDiarrea 10 a 19,9 cc/Kg/día o nauseas persistentes biopsia
de digestivo alto
3 Rash >50% Bilirrubinemia6,1 a 15 mg/dL Diarrea 20 a 30 cc/Kg/día
4 Eritroderma con vesículas generalizado Bilirrubinemia >15 mg/dL
Diarrea >30 cc/kg/día o dolor abdominal severo con o sin
íleo
Modificada para pacientes pediátricos, basada en Jacobson DA., Bone Marrow Transplantation (2008) 41, 215–221
Tabla N° 3.7.2 Clasificación Global de EICH crónica según Seattle Gluksberg Modificado Criterios de Consenso
Grado Órganos AfectadosPiel Hígado Intestino
I Estado 1 – 2 ---- ----II Estado 3 o Estado 1 o Estado 1III ---- Estado 2 – 3 o Estado 2 - 4IV Estado 4 o Estado 4 ----
Basada en Jacobson DA., Bone Marrow Transplantation (2008) 41, 215–221
Tabla N°3.7.3 Clasificación de severidad de EICH crónica aplicablea todos los órganos afectados
Score Clínica0 Sin síntomas1 Sin compromiso significativo de la vida diaria2 Compromiso significativo de la vida diaria pero sin discapacidades mayores3 Compromiso significativo de la vida diaria y discapacidades mayores

589
Trasplante de progenitoreshematopoyéticos en pediatría
Tabla N°3.7.4 Drogas Inmunosupresoras utilizadas en EICH
Droga Mecanismo deAcción Dosificación Efecto Adverso Administración
Metil-prednisolona
InmunomoduladorAntiinflamatorio Suprime migración Polimorfonucleares
1-4mg/kg/día Presentación IV 500mg/4mL
Edema, hipertensión, ulcera péptica, leucocitosis, osteoporosis, Fracturas, hiperglicemia
<125mg/mL IV en 3 min125-250mg IV en 15 min250-500mg IV en 30 min>500mg IV en 30-60 min
Prednisona InmunomoduladorAntiinflamatorio Suprime migración Polimorfonucleares
0.05-2mg/kg Presentación VO Comprimidos 1; 5 y 20mg
Edema, hipertensión, ulcera péptica, leucocitosis, osteoporosis, Fracturas, hiperglicemia, hepatotoxicidad
Después de las Comidas o productos lácteos.
Ciclosporina Bloqueador de las Calcineurinas.Inhibe producción y liberación de Interleukina 2.
IV: Iniciar con 3mg/kg/día Ajustar a niveles basales 200-300mg/L.Traslape VO 2 a 3 veces dosis IV: 5 a 15mg/kg/día, Ajustar a niveles basales 150-300mg/dL.
Nefrotoxicidad, hipertensión, neurotoxicidad, alteraciones electroliticas, hepatoxicidad, neutropenia, reacción alérgica
Dosis IV en SF en solución de 2mg/mL con estabilidad de 24hrs, administración de 2-6 h infusión intermitente o Infusión continua de 24 h en Envases libre de PVC (Bolsas EVA).
Tacrolimus Inhibe inmunofilinas especifica que bloquea la acción de la calcineurina y activación del linfocito T.
0.03-0.15mg/kg día IV, por 72 a 96 h luego evaluar niveles 10-15mg/L. Traslape a VO 3 veces la dosis IV, en un margen de 0.1-0.3mg/kg/día en Niveles de 7-15mg/L.
Hipersensibilidad a componente en dosis IV, nefrotoxicidad, hipertensión, neurotoxicidad, alteraciones hidroelectrolíticas, hepatoxicidad, neutropenia.
Dosis IV en SF en solución 0.004-0.02mg/L 72h de estabilidad, debe ser administrada en infusiones de 24 h. en envases libre de PVC (bolsas EVA).En dosis pediátricas utilizar suspensión oral de 0.5mg/mL
Sirolimus Reduce la activación dellLinfocito T por inhibición de interleuquina II y además tiene acción supresora sobre mTOR.
Pacientes <40kg dosis de carga 3mg/m2 y mantención 1mg/ m2 cada 12hrs, Pacientes >40kg D.C. 6mg y D.M. 2mg/24 h.Niveles Trough: 6-15mg/L
Hipertensión, edema periférico, alteraciones endocrinas, elevación de transaminasas, pancitopenias.
Comprimidos de 1-2 mg VO y suspensión oral de 1mg/mL
Pentostatina Es un antimetabolito de purinas específicamente de adenosin deaminasa, purina especifica de la síntesis de DNA de linfocito T
1.5mg/ m2 por 3 días en la semana, repetir dos semanas después si es necesario en EICH agudo.4mg/m2 cada 2 semanas por 12 semanas EICH cr.
Reacción anafiláctica,neurotoxicidad, cardiotoxicidad, elevación de transaminasas, mialgias, nefrotoxicidad, toxicidad pulmonar
10mg/5mL IV, diluir a 25-50mL de SF o SG5%, administrarlo en infusión de 20-30min.Administrar con premedicación.Mantener una adecuada hidratación de 2 a 3 litros el día de la infusión.

590
Guías ClínicasSociedad Chilena de Trasplante
Infliximab Anticuerpo monoclonal inhibidor del factor de necrosis tumoral alfa (TNF)
5-10mg/kg semanal cada 2 semanas por 6 semanas.frasco de 100mg
Reacción anafiláctica severa, hipotensión, neurotoxicidad, dolor abdominal, hepatoxicidad, falla renal, mialgias
En SF en solución de 0.4-4mg/mL, administrar en 2-3 horas, administrar con premedicación.Evaluar uso de esquema de goteo de aumento de velocidad cada 15 min, la primera hora.
Daclizumab Anticuerpo monoclonal humanizado IgG1 que tiene alta afinidad por el receptor de interleukina II inhibiendo la proliferación celular.
Es utilizado como adyuvante en terapias inmunosupresoras.0.5-1.5mg/kg cada 11 o 48 diasSolución IV de 25mg/5mL.
Reacción anafiláctica severa, hipotensión, neurotoxicidad, sangrado, constipación, diarrea, visión borrosa, necrosis tubular renal, toxicidad pulmonar.
En SF en solución de 1mg/mL administrar en 4 h. administrar con premedicación.estabilidad de 24 h.
Etarnercept Agente que bloquea el factor de necrosis tumoral alfa
0.8mg/kg subcutáneo una vez a la semana máximo de dosis 50mg. En sitio de inyección, o 0.4mg/kg dos veces por semana máximo 25mg . En sitio de inyección.frasco de 25mg/1mL SC o 50mg/1mL SC
Reacción anafiláctica severacardiotoxicidad aguda, rash cutáneo, angioedema, parestesias, dolor muscular, pancitopenias, dolor en el sitio de la inyección.
Alternar la zona de Inyección
Timoglobulina de Fresenius
Acción citotóxica sobre linfocito T en sangre periférica y alteración de la función del linfocito T.
20mg/kg día, presentación IV, 25mg/5mL.Requiere premedicación para su indicación.
Reacción anafiláctica severa, hipotensión-hipertensión, fiebre, broncoespasmo, hiperkalemia, dolor abdominal.
En S.F. en volumen total de 300-500 mL, de acuerdo al peso del paciente.
Timoglobulina de Sangstat
Acción citotóxica sobre linfocito T en sangre periférica y alteración de la función del linfocito T.
3mg/kg día presentación IV, 100mg/5mL,Requiere premedicación para su indicación.
Reacción anafiláctica severa, hipotensión-hipertensión, fiebre, broncoespasmo, hiperkalemia, dolor abdominal,aumento de transaminasas
En S.F. en solución a 0.5-2mg/mL, estable 48h.
Rituximab Anticuerpo monoclonal que tiene acción citotóxica sobre CD20(precursor de linfocito B)
375mg/ m2 día, presentación IV, 500mg/50mL y 100mg/10mL. requiere premedicación para su indicación.
Reacción anafiláctica severa, hipotensión, fiebre, broncoespasmo, hiperglicemia, ins. renal aguda.
En S.F. en solución a 1-4mg/mLes estable 24 h, la administración es mínimo 4 h, con esquema:1. - 25mg/h (30min).2.- 50mg/h (30min)3.- 100mg/h (hasta finalizar) en peso>70kg, puede aumentar a 200mg/h.

591
Trasplante de progenitoreshematopoyéticos en pediatría
Imatinib Inhibe de forma competitiva el gen Bcr-Abl (Tirosin Quinasa), inhibiendo la proliferación e induciendo la apoptosis de células leucémicas, ejerciendo además un efecto antinflamatorio específicos que disminuye la incidencia de EICHcr.
100mg/día, presentación comprimidos de 100mg.
Náusea, vómitos diarrea, edema-retención de fluidos, hemorragias, neutropenia, anemia, trombocitopenia, elevación de transaminasas, hiperbilirrubinemia
Administración oral, con abundante líquido.Debe ser administrado con máxima precaución con Paracetamol (aumenta riesgo de hepatoxicidad) y evaluar el uso de inhibidores del Citocromo P-450
Montelukast Antagonista de receptor de Leucotrienos CysLT1 receptor inducido por eosinófilos, que participa en la cascad de GVHD.
5mg/día VO, presentación de comprimidos de 10 y 5mg.
Náusea, vómitos diarrea, edema-retención de fluidos
Administración oral, con abundante líquido.Su efecto terapéutico tiene un peak de tratamiento de 10 meses.
3.8 complicaciones aguDas en el trasplante De progenitoresHematopoyéticos.
Las complicaciones que se presentan posterior al trasplante son el resultado de la compleja interacción de múltiples factores tales como: la patología de base (oncológica versus no-onco-lógica), el tratamiento previo de los pacientes (tipo e intensidad), las infecciones previas y sus secuelas, el tipo de acondicionamiento (mieloablativo o no mieloablativo), el tipo de donante (autólogo, alogénico, etc.) y de características del donante y el receptor (sexo, serologías vira-les, etc.). (1)
Las complicaciones agudas son aquellas que ocurren antes del día +100 post-trasplante. (Figu-ra N°3.8.1). Según la etiología es posible clasificar estas complicaciones en tóxicas, infecciosas e inmunológicas.
Complicacionestóxicas:
Mucositis:Definiciones: Es un proceso inflamatorio de la mucosa oral y gastrointestinal secundaria a los regímenes de quimioterapia y radioterapia. Clínicamente produce odinofagia, sialorrea, nausea, anorexia, dolor abdominal y diarrea, puede llevar a la deshidratación, desnutrición y muerte. El grado de severidad debe ser consignado mediante una escala validada y reproduci-ble como la escala OMS para mucositis oral (tabla N°3.8.1). (2) La presencia de mucositis seve-ra se asocia con un aumento de la mortalidad post-trasplante principalmente por infecciones debido al daño de la barrera mucosa. (2)
Manejo:- Prevención: No existen medidas preventivas demostrada en pacientes pediátricos, en
adultos, se recomienda el uso de 1.- lavados bucales con hielo picado, 2.- terapia con laser de bajo nivel (LLLT: low-level laser therapy) y 3.- factor de crecimiento de kerati-

592
Guías ClínicasSociedad Chilena de Trasplante
nocitos-1. (2)
- Manejo del Dolor: Se deben usar escalas adaptadas para la edad. (3) El tratamiento debe iniciarse precozmente, evaluaciones periódicas por el personal de salud son ne-cesarias. Se han utilizado enjuagues salinos, hielo y enjuagues con lidocaína al 2%. Se recomienda iniciar analgésicos con dolor 3 en escala de 10, los analgésicos de elección son los opioides por vía iv (morfina). Donde esté disponible, se recomienda el uso de anestesia controlada por el paciente (PCA). (4) En mucositis perianales se pueden uti-lizar polímeros para cubrir sitios irritados; no poseen acción analgésica per se pero al aislar disminuyen dolor.
- Soporte Nutricional: Es necesaria la medición diaria de ingesta y evaluar periódica-mente la tolerancia a los alimentos. (2) Se recomienda intentar la alimentación por vía enteral mediante sonda nasogástrica y/o nasoyeyunal, en caso de que no haya toleran-cia se debe iniciar nutrición parenteral (5), idealmente manteniendo estímulo enteral.
- Descontaminación de la mucosa oral: Utilizar protocolos de aseo bucal que incluyan de acuerdo con las condiciones del paciente, el cepillado de dientes con cepillo de cerdas suaves, uso de hilo dental, enjuagues bucales con solución salina con o sin bi-carbonato. No está recomendado el uso de enjuagues con clorhexidina ni soluciones que contengan alcohol, tampoco se recomienda el uso de nistatina tópica (4). Se reco-mienda el uso de fluconazol sistémico. (6)
- Manejo de sangrado: Se recomienda mantener recuentos de plaquetas mayores a 20.000/mL4. Se han utilizado tratamientos tópicos como pegamento de fibrina (7) y antifibrinolíticos tópicos. (8) 3.7.1.1.2.6.- Evitar la sequedad de las mucosas: enjuagues bucales con agua, solución bicarbonatada, saliva artificial, mascar chicle sin azúcar y medicamentos colinérgicos para estimular secreción de saliva. (4)
- Instaurar medidas de tratamiento etiológico: La crioterapia ha demostrado ser efectiva con el uso de melfalan (9) y 5-fluoracilo. (10) Otras estrategias han tenido resultados contradictorios que no permiten su recomendación: amifostine, glutamina oral o pa-renteral, anti inflamatorios no esteroidales y G-CSF oral. (11) Ha habido resultados promisorios con el factor de crecimiento de keratinocitos-1 y con LLLT pero no han sido aprobados en niños aún.
ReacciónaDimetilsulfóxido(DMSO)Definiciones: El DMSO es una sustancia de olor penetrante que se utiliza en la criopreser-
vación de los tejidos. La administración de DMSO produce liberación de histamina y su uso se ha asociado a: cefalea, vértigo, náuseas, prurito, cambio en sabores, disnea, dolor abdominal tipo cólico, rash eritematoso, diarrea, calofríos, fiebre, hipertensión, anafilaxia, hipotensión, hemólisis intravascular, efectos vagotónicos y arritmias. (12)
Manejo:- Prevención: No exceder la dosis de DMSO de 1g/Kg de peso del receptor/día si es
necesario se deben infundir los progenitores en dos o más días (13), premedicar a los pacientes con antihistamínicos y/o corticoides (14), antipiréticos, antieméticos y diuré-ticos e hiperhidratar al paciente antes, durante y posterior a la infusión. Se recomienda la monitorización del paciente antes durante y después de la infusión, al menos 6 ho-ras. (15)
- Tratamiento: En caso de reacción adversa se debe disminuir la velocidad de infusión

593
Trasplante de progenitoreshematopoyéticos en pediatría
(15); en caso de hipotensión, administrar volumen extra; las reacciones alérgicas leves o moderadas responden al uso de antihistamínicos y corticoides en dosis extra, la ana-filaxia debe ser rápidamente detectada y tratada por el riesgo vital que conlleva(16), el medicamento de elección en ese caso es la adrenalina intramuscular(17,18), en caso de bradicardia se debe administrar atropina.
Enfermedadveno-oclusiva(EVO)Definiciones: También llamado Síndrome de obstrucción sinusoidal, es una complicación
vascular caracterizada por obstrucción de los sinusoides (y vénulas) intrahepáticos producida por la toxicidad del acondicionamiento sobre el endotelio (1). Se sugiere utilizar los criterios de Baltimore que establecen el diagnóstico con la elevación de la bilirrubinemia mayor o igual a 2 mg/dL antes del día 21 post TPH y al menos dos de los siguientes criterios: 1.- Hepatome-galia dolorosa, 2.- Aumento de peso de 5% de valor basal 3.- Ascitis. (19) La presencia de EVO aumenta la mortalidad en un 20-50% dependiendo del grado de severidad (tabla N°3.8.2). (1)
Manejo:- Prevención: Se han probado heparina en dosis bajas, heparina de bajo peso molecular,
pentoxifilina, prostaglandina E1 (PGE1) y ácido ursodeoxicolico con resultados con-tradictorios. (20,21) Más recientemente se ha utilizado el defibrotide con resultados promisorios. (22)
- Tratamiento: Los casos leves no requieren tratamiento etiológico y se resuelven es-pontáneamente, la base del manejo son las medidas de soporte. (20) El tratamiento recomendado actualmente es el defibrotide; dosis de 10 mg/kg de peso día, único medicamento con resultados consistentes de éxito. (23) Tratamientos no farmacológi-cos: shunts portosistémicos intrahepáticos hechos mediante cateterismo transyugular (TIPS) no mejora sobrevida (24), incluso el trasplante de hígado ha sido utilizado (21), pero no se recomienda plantearlo a pacientes con TPH.
MicroangiopatíaTrombótica(MAT)Definiciones: Es una de las más severas manifestaciones de daño endotelial posterior al
trasplante. Se produce trombosis arteriolar, asociado a edema y necrosis de la pared de los vasos pequeños. Para el diagnóstico deben cumplirse completamente los criterios del Interna-tional Working Group consensus (25). Tabla N°3.8.3.
Manejo:- Prevención: No hay medidas específicas.
- Tratamiento: La primera medida es suspender los posibles medicamentos responsa-bles (Ciclosporina y Tacrolimus) inmediatamente y reeaplazarlos por corticoides, aza-tioprina o micofenolato. (26) Se debe hacer un manejo agresivo de infecciones o EICH puesto que generalmente son estas las causas de muerte. Ninguno de los tratamientos efectuados ha demostrado éxito y su uso debe ser planteado solo como experimental o compasivo: plasmaferesis (27) con o sin inmunosabsorción con proteína A de Sta-phyloccocus (27), Daclizumab (anticuerpos anti CD25) (29), Defibrotide (30), Rituximab (anticuerpos anti CD20) (31), Ácido eicosapentaenoico (ácido graso omega 3) (32) e iso-sorbide transdérmico. (33)

594
Guías ClínicasSociedad Chilena de Trasplante
CistitisHemorrágicaDefiniciones: Presencia de hematuria sostenida y síntomas urinarios bajos: disuria, polia-
quiuria, tenesmo, en ausencia de otras alteraciones como sangrado vaginal, trastornos de coa-gulación e infecciones urinarias fúngicas o bacterianas (34). Existen dos períodos de máxima incidencia, a las 72 horas post infusión que está asociada a toxicidad por quimioterapia (por ejemplo: ciclofosfamida, busulfán y etopósido) y la que ocurre 1 mes post infusión que está rela-cionada con presencia de partículas virales en orina especialmente Poliomavirus y Adenovirus. Clínicamente es necesario categorizar la cistitis hemorrágica según su severidad. (1) Tabla 3.8.4.
Manejo:- Prevención: Tres medidas han demostrado ser efectivas: uso de mesna, hiperhidrata-
ción con diuresis forzada e irrigación vesical continúa. Ninguna de estas estrategias ha demostrado superioridad sobre otra y la combinación de las tres reportan el mejor resultado. (35) Hay reportes de disminución significativa de la incidencia de Cistitis hemorrágica con los acondicionamientos no mieloablativos. (36)
- Tratamiento: Se utiliza hiperhidratación alcalinizante, irrigación vesical, transfusión de plaquetas, tratamiento de las infecciones (por ejemplo con cidofovir) y en casos más graves oxigeno hiperbárico o cirugía para descomprimir la vía urinaria. (1)
ComplicacionesInfecciosas:Definiciones: Son la principal causa de morbilidad y de mortalidad posterior al trasplante.
La mayor incidencia y severidad se correlaciona con el mayor uso de inmunosupresores, el mayor tiempo de recuperación de neutrófilos y la reconstitución inmune más lenta. (37) El tipo de infección a la que están expuestos los pacientes trasplantados varía en el tiempo. Fi-gura N° 3.8.1
Las infecciones bacterianas ocurren especialmente en el periodo pre-implante debido a la pre-sencia de neutropenia y mucositis. Se presentan con una incidencia similar en el trasplante au-tólogo y alogénico (30-35%). (38) Las etiologías predominantes corresponde a cocáceas Gram (+) en el 75% de los aislamientos (Streptoccocus viridans y Staphylococcus coagulasa negativo) y bacterias Gram (-) en el 25% (Pseudomonas aeruginosa y enterobacterias). Post-implante y en períodos más tardíos aún existe riesgo de infecciones bacteriana, especialmente a bacterias encapsuladas (Streptococcus pneumoniae). (37)
Los virus son un problema durante todo el proceso del trasplante. Los virus respiratorios y los enterovirus tienen una incidencia alta y estable. Post implante cobran importancia los virus de la familia herpesviridae especialmente el citomegalovirus y el virus de Epstein Barr. Adenovirus (ADV) ha emergido como patógeno oportunista en los receptores de trasplante hematopoyético. (39) Otros virus también juegan roles patógenos por ejemplo virus BK, par-vovirus B19, virus herpes humano 6.
Con respecto a las infecciones fúngicas, en el periodo pre-implante existe un alto riesgo de candidemia, controlada con el uso sistemático de profilaxis. En el periodo post-implante el mayor riesgo es de infección por Aspergillus spp.. No debe olvidarse otros agentes como zygo-micetes y Fusarium spp. (37)
El Pneumocystis jirovecii es un patógeno que ocasiona patología respiratoria severa. Temporal-mente el riesgo se mantiene mientras se encuentre comprometida la inmunidad celular, vale decir hasta por lo menos el primer año post- trasplante. El uso de profilaxis está ampliamente recomendado para este patógeno. (37)

595
Trasplante de progenitoreshematopoyéticos en pediatría
Los parásitos han sido poco estudiados. En nuestro medio aun son frecuentes como Toxoplas-ma gondii y pueden producir infecciones graves y secuelas importantes. (37)
Manejo:- Prevención: Medidas generales y profilaxis específicas primarias y secundarias.
1. Medidas Generales: Cumplir con mediadas de aislamiento y de infraestructura ade-cuadas (ver capítulos correspondientes). (40) La descontaminación intestinal con an-tibióticos no absorbible es controvertido. Se recomienda en los trasplantes alogénicos hasta que el paciente se recupere de la neutropenia. (40) El empleo de Inmunoglobu-lina endovenosa se utiliza para la inmunoprofilaxis pasiva contra virus y bacterias y además tiene un rol inmunomodulador en EICH aguda dosis 400 mg/ kg 1 vez a la semana durante los primeros tres meses y se mantiene a intervalos de 3 semanas en los casos de EICH crónica. (40)
2. Profilaxis específicas: Pneumocystis jirovecii: Sulfametoxazol- Trimetoprim a dosis de 5 mg/ kg/día de trimetoprim, por tres días consecutivos a la semana a partir de la re-cuperación de neutrófilos (PMN > 0,5 x 109/L) y hasta por lo menos el primer año pos trasplante. (37)
Virus herpes simplex: Aciclovir a dosis de 1500 mg/m2/día dividido en 3 dosis, desde el día -7 al día +30 o hasta que se suspenda la inmunosupresión, previene efectivamente de reactivación a los pacientes con serología positiva previo al trasplante. (40)
Citomegalovirus: (CMV) Uso de Hemoderivados filtrados y depletados de linfocitos para prevenir la infección asociada a transfusiones. (40)
Antifúngica: Se realiza desde el período de acondicionamiento hasta el día +75 y /o mientras se mantenga la inmunosupresión por EICH. (37) Tradicionalmente se utiliza Fluconazol 3 mg/kg/día, se ha validado el uso de Voriconazol y otros. (37)
- Tratamiento: Neutropenia febril: Definida por la presencia de neutropenia severa (RAN≤ 500/mm3)
y temperatura axilar ≥ 38,3°C. No existen guías de manejo específicas para el pacien-te sometido a TPH pediátrico. Se recomienda manejar como paciente de alto riesgo según normas nacionales de Neutropenia febril en pacientes pediátricos con cáncer: Inmediatamente se debe cultivar: urocultivo y hemocultivos desde cada lumen de vías centrales y por punción periférica, u otro sitio si procede según clínica, solicitar radio-grafía de tórax e iniciar tratamiento antibiótico precozmente, se sugiere iniciar antibio-terapia con cobertura anti-Pseudomonas (ceftazidima), y glicopéptidos para cocáceas Gram (+) meticilina resistentes (vancomicina). (41) La asociación con aminoglucósidos ha sido discutida pero es una estrategia válida según los patrones de resistencia de los bacilos Gram negativo en cada institución. (41) Si el paciente evoluciona bien, sin fiebre, sin foco clínico y estudio microbiológico negativo. Mantener esquema antibió-tico hasta logar por lo menos 4 días afebril (no menos de 7 días). Si el paciente está en buenas condiciones generales, sin signos de infección clínica, pero con cultivo positivo. Mantener o adecuar el tratamiento antibiótico de acuerdo al germen aislado, hasta la negativización de los cultivos (no menos de 14 días). Evolución desfavorable después de 72h de tratamiento (Persistencia de la fiebre, inestabilidad hemodinámica, apari-ción de un nuevo foco sugerente de infección bacteriana invasora, medición seriada de PCR sin reducción significativa a las 72 horas, o en ascenso o persistencia de cultivos

596
Guías ClínicasSociedad Chilena de Trasplante
(+) a las 72 horas de tratamiento): si no se ha incorporado antes se debe agregar tercer antibiótico (Amikacina) o utilizar segunda línea con Tazobactam-Piperacilina o Me-ropenem. (41) Se sugiere además en este punto realizar estudio extendido de foco y evaluar el inicio del tratamiento antifúngico empírico:
1. Digestivo: Deposiciones: coprocultivos, cultivo para cryptosporidium, mycrosporidium, rotaforesis, Reacción de polimerasa en cadena (PCR) para adenovirus en deposiciones, toxina de Clostridium difficile. Imágenes: radiografía abdominal, ecografía abdominal, considerar realización de TAC de abdomen y pelvis. Endoscopia digestiva alta con biopsia si procede. Estudio pancreático con amilasa y lipasa seriadas en caso de dolor abdominal y/o hiperemesis.
2. Respiratorio: Imágenes: Radiografía de tórax, TAC de pulmón, TAC de cavidades pa-ranasales. Aspirado nasofaringeo para realización de inmunofluorescencia viral. Rea-lización de Lavado broncoalveolar: estudio de PCR para Pneumocystis jirovecii, PCR para CMV, PCR para Mycoplasma pneumoniae, PCR para Mycobacterium tuberculosis, IFI para ADV y VRS, cultivo aerobio, anaerobio, hongos, Mycobacterium tuberculosis y baciloscopía. Se debe realizar estudio citológico. Considerar la realización de biopsia pulmonar según proceda. Punción de cavidades paranasales para estudio citológico, cultivos y biopsia.
3. Sistema nervioso central: Considerar hallazgos clínicos. TAC cerebral, RNM cerebral, Electroencefalograma, punción lumbar para citológico, citoquímico y látex para bacte-rias y Cryptococcus neoformans, cultivo aerobio, anaerobio, para hongos, baciloscopía y cultivo para Mycobacterium tuberculosis, PCR para Mycobacterium tuberculosis, PCR para hongos, IgG e IgM para Toxoplasma, calcoflúor. PCR Toxoplasma y Chagas. Considerar realización de biopsia si procede.
4. Otros: Ecocardiograma, cintigrama óseo, estudio imagenológico completo (TAC cere-bral, cavidades paranasales, pulmón y abdomen). No olvidar las infecciones asociadas a dispositivos tales como catéter, prótesis, etc.
Infeccionesviralesespecíficas- Citomegalovirus: Terapia anticipada o pre-emptive: implica una vigilancia estrecha de
la reactivación viral mediante Reacción de polimerasa en cadena (PCR) para ADN de CMV (cuantitativa) y desde recuento de linfocitos mayor a mil con antigenemia para CMV con el objetivo de iniciar el tratamiento antiviral frente a reactivación viral, antes de que se presenten síntomas. (37) Se recomienda vigilancia semanal desde el periodo de implante hasta el día +100. (42) Se prolonga la vigilancia hasta los 12 meses post trasplante en pacientes con EICH, trasplante alternativo. (42) Se recomienda iniciar con Ganciclovir 5 mg/kg/12h iv x 14 días.. (12) Si se logran dos Antigenemias o dos PCR CMV (-) se continúa con 10 dosis de mantención de Ganciclovir 5 mg/kg/24h iv Si durante el tratamiento aumenta el nº de células positivas o de copias virales se puede utilizar tratamiento de segunda línea: Cidofovir, Ganciclovir y Foscarnet. (42). Durante el tratamiento de la reactivación viral es necesario considerar disminución de la inmunosupresión, evaluando riesgo/ beneficio ante la presencia de EICH. El uso GGIV inespecífica para CMV en la prevención de la infección o de la enfermedad, no está recomendada. (37) Enfermedad por CMV: el diagnóstico debe estar basado en la presencia de síntomas y signos sugerentes de enfermedad citomegálica y la detección de CMV en el tejido del órgano involucrado (42). Está recomendado el tratamiento con Ganciclovir. (42) En este caso puede usarse GGiv. (42) No hay consenso en cuanto

597
Trasplante de progenitoreshematopoyéticos en pediatría
a la duración de la terapia, se sugiere mantener por 21-28 días, con mantención de 4 semanas.
- Adenovirus: Infección: Detección DNA en sangre periférica. (+) >1000 copias/ml, Enfer-medad: infección asociada a sintomatología: 1.-Gastrointestinal: diarrea, colitis hemo-rrágica, hepatitis, 2.-Pulmonar, 3.-Vía urinaria: cistitis hemorrágica, insuficiencia renal, 4.-Infección nasofaríngea asintomática, 5.-Enfermedad Diseminada: caracterizada por fiebre prolongada, proteína C reactiva ≥ 100, falla multiorgánica: SNC, retinitis, falla cardiaca, hepatitis, insuficiencia renal. Estrategia pre-emptive: Basado en estudios retros-pectivos (no aleatorios-controlados), y recomendación de expertos, se hace vigilancia en pacientes de riesgo (acondicionamiento no mieloablativo y donantes alternativos) con PCR para ADN viral en sangre hasta el día +100. Se ha asociado el riesgo de di-seminación con la presencia de una carga viral elevada en sangre periférica (≥ 10 x 4 copias ml.) (39) por lo que se inicia tratamiento. Se utiliza Cidofovir: dosis 5 mg /kg /semanal dividido en 3 días por 2 dosis, luego si la carga viral disminuye, se debe con-tinuar con 1 dosis semana alterna hasta obtener 2 PCR (-). Premedicación con probe-necid e hiperhidratación. Se deben evitar nefrotóxicos, monitorizar función renal con creatinina plasmática y proteinuria antes de 48 horas de dosis. Luego de tratamiento se mantiene vigilancia semanal con PCR (+) en sangre y deposición. Si existen síntomas se debe buscar en orina, nasofaríngeo y lavado broncoalveolar. Se debe considerar la disminución de la inmunosupresión.
- Virus Epstein Barr: La reactivación del VEB se ha asociado con la aparición del síndrome linfoproliferativo post trasplante (PTLD) por lo que se recomienda la vigilancia activa y seriada y el tratamiento pre-emptive en pacientes de riesgo acondicionamiento no mie-loablativo y donantes alternativos. (43,44) Se recomienda hacer PCR en sangre o plasma semanal y si dos mayor a 1000 copias de ADN/mL se debe iniciar tratamiento con Rituxi-mab 375 mg/m2 semanal al menos 4 semanas e intentar suspender toda inmunosupresión o reducirla sólo a corticoides. Si pasadas las 4 semanas persiste positiva se deben dar dos semanas más de tratamiento y evaluar. Se puede suspender tratamiento con dos PCR VEB negativas. (45,46) Se debe hacer estudio de PTLD con electroforesis de proteínas plasmáticas, LDH, inmunoglobulinas, TAC tórax, abdomen y pelvis, si se identifica una masa, biopsiar y realizar inmunohistoquímica buscando CD20. En caso que se demuestre PTLD o que no responda a dos semanas adicionales de Rituximab, debe plantearse el uso de tratamientos de segunda línea: quimioterapia y/o infusión de linfocitos. (47)
Infeccionesfúngicasespecíficas: Definiciones: Hay dos modalidades terapéuticas: Tratamiento Empírico y Tratamiento
Anticipado o pre-emptive. La primera inicia tratamiento antifúngico ante la persistencia de fiebre más allá de 3- 5 días de iniciado un esquema antibiótico de amplio espectro en el contexto de un paciente neutropénico. La segunda implica la búsqueda prospectiva de infección fúngica con detección semanal de antígeno Aspergillus e iniciar tratamiento antifúngico frente a la presencia de criterios de infección fúngica invasora (IFI) según la European Organization for Research and Treatment of Cancer/Mycoses Study Group (41) (Tabla N °3.8.5 y N° 3.8.6). Se recomienda estrategia de tratamiento empírico para trasplan-tes autólogos y alogénicos de hermano compatible y estrategia pre-emptive en acondiciona-miento no mieloablativo y donantes alternativos. Un retraso en el inicio de tratamiento de una aspergilosis o candidiasis está asociado a un aumento de la mortalidad (48,49). Desde un punto de vista clínico se debe iniciar tratamiento antifúngico frente a una IFI posible, probable y comprobada.

598
Guías ClínicasSociedad Chilena de Trasplante
Antes de iniciar un tratamiento antifúngico se debe con búsqueda de antígeno de Asper-gillus (galactomanano), examen de fondo de ojo, búsqueda de hifas o seudohifas en orina, biopsia y cultivo de piel, y estudio de diversos parénquimas por imágenes: TAC de cere-bro, cavidades paranasales, pulmón, abdomen y pelvis. (41)
Antifúngicos: Anfotericina B si sospecha de candidemia: dosis 1 - 3 mg/kg/día. Se debería preferir la preparación liposomal ya que posee menos efectos adversos. Voriconazol si se sospecha aspergillosis, mientras se realiza el estudio. (48) Dosis 6 mg/Kg/ iv cada 12 horas por 1 día, luego continuar con 4 mg/kg iv cada 12 horas. En infección fúngica invasora probada: se recomienda 6-12 semanas. Puede utilizarse la vía oral, una vez que la infección esté controlada. (48)
Infección por Toxoplasmosis: La profilaxis con sulfametoxazol-trimetoprim estaría reco-mendada para aquellos sero-positivos con EICH activo o con historia previa de coriorre-tinitis, pero los estudios que avalan tiene una eficacia limitada. En caso de reactivación posterior al trasplante, el tratamiento debe ser indicado y monitorizado en conjunto con el especialista en parasitología. (50)
ComplicacionesInmunológicas:
FalladeImplante Definiciones: Implante: 1.- Biológica: Inicio de la función hematopoyética de las células in-
fundidas. 2.- Clínica: Neutrófilos: Primer día de tres consecutivos con recuento mayor a 500 células/µL (51); Plaquetas: Recuento mayor a 20.000/ µL sin transfusiones por 7 días (PuedeµL (51); Plaquetas: Recuento mayor a 20.000/ µL sin transfusiones por 7 días (Puede considerarse recuento >50.000 o > 100.000/µL); Glóbulos Rojos: Hemoglobina 8g/dL sin necesidad de transfusiones o reticulocitos ≥ 1%. Falla de implante: destrucción de las células del donante por el sistema inmune residual del receptor. Se manifiesta por neutropenia prolongada y quimerismo autólogo persistente. (52)
La falla de implante puede ser: 1.- Primaria: las células del donante no logran implantar, no existe evidencia de algún marcador genético del donante. Según la fuente de progeni-tores es posible definir falla cuando no logra implante de neutrófilos al: Día +21 en TPH de sangre periférica. Día +28 en caso de médula ósea. Día + 45 en caso de SCU. 2.- Secun-daria: pérdida del implante inicial. El paciente inicialmente cumple criterios de implante y luego los pierde; desarrolla citopenia de al menos dos líneas celulares. Habitualmente se caracteriza por pancitopenia aguda, fiebre alta, eritema cutáneo y marcadores de respuesta inflamatoria (PCR elevada, LDH aumentada. (52)
Manejo:- Prevención: No existen medidas de prevención; la extracción de médula autóloga
previo a TPH, para rescate, es una medida controvertida.
- Tratamiento: No existen guías clínicas de manejo ante el fallo de implante. Se deben descartar diagnósticos diferenciales: recaídas e infecciones. (52) En TPH autólogo: Sin manipulación ex vivo de los PH: Sangre periférica: G-CSF 10 mcg/kg/día (sc) a partir del día +21; si no hay recuperación a los 2 – 3 meses del TPH: TPH alogénico. Médula ósea: G-CSF 10 mcg/kg/día (sc) a partir del día +28. Si no hay recuperación a los 2 – 3 meses del TPH: TPH alogénico. TPH alogénico Donante Familiar: Se utili-za G-CSF 10 mcg/kg/día (sc) a partir del día +21. Si no hay respuesta tras 8 días de tratamiento: 2º TPH tras inmunosupresión con ATG de conejo. Sangre de cordón umbilical: G-CSF a partir del día + 28. Evaluar el día +45: En pacientes con reserva

599
Trasplante de progenitoreshematopoyéticos en pediatría
de PH autólogos: infusión de la reserva. En pacientes que no disponen de reserva: búsqueda de un donante para un 2º TPH.
ElSíndromedeImplante Definiciones: Reacción inflamatoria sistémica, producida por la liberación masiva de ci-
toquinas, durante el implante de neutrófilos. Difícil diagnóstico con EICH aguda. Existen criterios diagnósticos (Tabla N° 7) (53).
Manejo:- Prevención: No se conoce.
- Tratamiento: No existe consenso de manejo ni guías clínicas. Tratamiento soporte in-tensivo. Primera línea: corticoides dosis “pequeñas” metilprednisolona 1mg/Kg/día, respuesta en 1 a 3 días. Segunda línea: experimentales, plantear uso compasivo o de investigación. (53).
LaEICHagudaycrónicaseexponeampliamenteenotrasección
Figura N° 3.8.1. Complicaciones asociadas a trasplante en el tiempo
Inmunológicas. RA: Reacción Anafiláctica, EICH: Enfermedad del Injerto Contra el Huésped, Sd Imp: Síndrome de Implante. Tóxicas. RT: Reacción Tóxica por Dimetilsulfóxido, EVO: Enfermedad Veno-Oclusiva, CH: Cistitis Hemorrágica, MAT: MicroAngiopatía Trombótica
Tabla N°3.8.1. Escala OMS para clasificación de la severidad de la mucositis oral
Grado Clínica0 Sano1 Eritema2 Eritema + úlcera, puede comer sólidos. Dolor ligero3 Eritema, edema, úlcera, Sólo tolera líquidos. Dolor intenso4 Soporte enteral o parenteral. Dolor Severo

600
Guías ClínicasSociedad Chilena de Trasplante
Tabla N°3.8.2 Severidad de la enfermedad Veno-Oclusiva
LEVE MODERADA SEVERASe resuelve sin intervención Requiriere tratamiento Insuficiencia respiratoria
(saturación < 90%)Bilirrubina Total ≥ 6 mg/dL Síndrome hepatorrenalGPT > 5 veces valor normal EncefalopatíaAumento de peso 5% Falla renal agudaascitis Bilirrubina total > 20 mg/dL
Tabla N° 3.8.3 Criterios diagnósticos de microangiopatía trombótica
Debe cumplir TODOS los criterios siguientesEsquistocitos en periferia > 4%Trombocitopenia de novo, prolongada o progresiva (< 50.000 o disminución sobre 50% de valores previos.Aumento de LDH, agudo o persistenteDisminución de hemoglobina o aumento de los requerimientos de transfusión.Disminución de la haptoglobina plasmática.
Tabla N° 3.8.4 Severidad de la cistitis hemorrágica
Grado Criterio1 Hematuria microscópica2 Hematuria macroscópica3 Hematuria microscópica con coágulos pequeños4 Hematuria microscópica y obstrucción del tracto urinario que requiere evacuación de los
coágulos
Tabla N°3.8.5 Criterios para infección fúngica invasora
1. CRITERIOS DEL HOSPEDERONeutropenia (≤ 500 neutrófilos/mm3) por más de 10 días
Fiebre persistente por ≥ 96 h, refractaria a tratamiento antibacteriano de amplio espectro.
T° corporal > a 38°C o < a 36°C y cualquiera de los siguientes factores:
a. neutropenia prolongada (> 10 días) en los 60 días previos,
b. uso actual o en los 30 días previos de inmunosupresión significativa
c. IFI probada o probable en episodio previo de neutropenia
d. coexistencia de SIDA sintomático
Síntomas o signos de EICH > grado 2 o enfermedad crónica extensa.
Uso prolongado (≥ 3 semanas) de corticoides en los 60 días previos

601
Trasplante de progenitoreshematopoyéticos en pediatría
2. CRITERIOS MICOLOGICOSCultivo (+) para hongo filamentoso, Cryptococcus neoformans u hongo endémico de una muestra de expectoración o LBA.
Cultivo (+) y/o citología directa (+) para hongos filamentosos de aspirado sinusal.
Citología directa (+) para hongos filamentosos o Cryptococcus spp. en muestra de expectoración o LBA.
Antígenos de Aspergillus (+) en muestras de lavado broncoalveolar, LCR o dos muestras de sangre.
Antígeno de Cryptococcus spp. (+) en sangre.
Citología (+) para hongo en una muestra de fluido normalmente estéril.
Antígeno (+) para Histoplasma capsulatum en muestras de sangre, orina o LCR.
Dos urocultivos (+) a levaduras en ausencia de sonda urinaria.
Presencia de cilindros de Candida spp en ausencia de sonda urinaria.
Hemocultivo (+) a Candida spp.
3. CRITERIOS CLÍNICOSINFECCIÓN RESPIRATORIA BAJA:
Mayor: TAC pulmonar: signo del halo o cavitación alrededor de un área de consolidación.
Menores: a. Síntomas de infección del tracto respiratorio bajo (tos, dolor torácico, hemoptisis, disnea).
b. Frote pleural
c. Cualquier infiltrado diferente a los de criterio mayor.
e. Derrame pleural.INFECCIÓN NASAL/ SINUSAL:
Mayor: Evidencia radiológica sugerente de infección sinusal (ej: Erosión de los senos nasales o exten-sión de la infección a estructuras vecinas, destrucción extensa de la base de cráneo)
Menores: a. Síntomas respiratorios altos (estornudos y descarga nasal).
b. Úlcera o escara en mucosa nasal o epistaxis.
c. Edema periorbitario y sensibilidad maxilar.
d. Lesiones negras necróticas o perforación del paladar duro.INFECCIÓN DEL SNC
Mayor: Evidencias radiológicas sugerentes de infección SNC (mastoiditis u otro foco parameningeo, empiema extradural, lesión intraparenquimatosa cerebral o espinal)
Menores: a. Síntomas y signos neurológicos focales (incluidas convulsiones focales, hemiparesias y parálisis de pares craneales).
b. Cambios mentales (conductuales y/o cognitivos)
c. Hallazgos de irritación meníngea.
d. Alteraciones bioquímicas y de recuento celular en el LCR (no compatibles con infección bacteriana o viral ni con compromiso neoplásico).

602
Guías ClínicasSociedad Chilena de Trasplante
INFECCIÓN FUNGICA DISEMINADA
a. Lesiones cutáneas papulares o nodulares sin otra explicación.
b. hallazgos intraoculares sugerentes de endoftalmitis o coriorretinitis fúngica hematógenaCANDIDIASIS DISEMINADA CRÓNICA
Pequeños abscesos periféricos en diana (lesiones tipo ojo de buey), lesiones similares en hígado y/o bazo, demostradas por TAC, RNM o Ecografía, unido con elevación de las fosfatasas alcalinas. No se requiere de criterio microbiológico para diagnóstico probable.CANDIDEMIA
No requiere de criterio clínico para diagnóstico probable. No existe definición de candidemia posible.
Tabla N° 3.8.6 Clasificación de las infecciones fúngicas invasoras
1. IFI probadaa. Infección de Tejidos Profundos
Hongo Filamentoso 1. Muestra tomada por biopsia o aguja fina que al examen histopatoló-gico o citopatológico muestre hifas y daño tisular.
2. Cultivo positivo de una muestra tomada con técnica aséptica de un sitio normalmente estéril con signos clínicos o radiológicos de infec-ción, excluyendo la orina y las membranas mucosas.
Levadura 1. Muestra tomada por biopsia o aguja fina que al examen histopato-lógico o citopatológico muestre células de levadura (en el caso de Candida s.f. pueden ser pseudohifas o hifas).
2. Cultivo positivo de una muestra tomada con técnica aséptica de un sitio normalmente estéril con signos clínicos o radiológicos de infección, ex-cluyendo la orina, los senos paranasales y las membranas mucosas. En caso de criptococosis de SNC basta microscopía (tinta china o tinción de mucicarmin) y/o determinación de un antígeno.
b. Fungemia
Hongo Filamentoso Hemocultivo positivo a un hongo, excepto Aspergillus spp. y/o Peni-cillium spp. diferente de Penicillium marneffei, asociado a síntomas y signos clínicos compatibles.
Levaduras Hemocultivo positivo a Candida spp. u otra levadura en un paciente con síntomas y signos compatibles.
2. IFI Probable
Cumple con al menos un criterio del hospedero, uno micológico y uno clínico mayor (o dos menores).
3. IFI Posible
Cumple al menos un criterio del hospedero y uno micológico o uno clínico mayor (o dos menores). No considerar esta categoría en estu-dios clínicos pero sí para tratamiento empírico.

603
Trasplante de progenitoreshematopoyéticos en pediatría
3.9 seguimientoposttpHycomplicacionescrónicas
El control ambulatorio del paciente trasplantado se regirá de acuerdo a la calendarización que corresponde al tipo de procedimiento efectuado. Según el tipo de donante, se programa-rán evaluaciones clínicas y de laboratorio.
Todos los pacientes serán controlados semanalmente post-alta hasta el día +100, luego cada 15 días hasta el 6 mes y mensualmente hasta el año. Posteriormente, de acuerdo a la evolución, se controlará cada 6 meses hasta los 2 años. El seguimiento a largo plazo se efectuará una vez al año o cada 6 meses en caso necesario hasta completar 5 años como mínimo, idealmente 10. Posterior-mente, de acuerdo a edad, el paciente será derivado a un centro hospitalario de adultos.
El control básico incluye:
• Historia Clínica
• Examen físico, peso, talla, control de signos vitales, desarrollo puberal si corresponde.
• Exámenes de acuerdo a protocolo.
• Ajuste de fármacos en uso
La información se debe registrar en la ficha clínica del paciente y en documentos de registro interno de la Unidad (ej: carpeta de policlínico, lista de pacientes electrónica).
Seguimientoinfectológico:Se efectuará control semanal de Antigenemia CMV hasta el día +100. En aquellos pacientes
con valores de CD4< 200 se mantendrá dicho control más allá de esta fecha. En los pacientes trasplantados con unidades de cordón umbilical no emparentado y haploidénticos, el control incluye la pesquisa infeccioso ampliado: PCR ADV, CMV, VEB, galactomanano. Semanalmen-te hasta el día+100, luego cada 15 días hasta el 6 mes, mensualmente hasta el año o hasta que se encuentren inmunoreconstituidos.
Tabla N°3.8.7: Criterios diagnósticos de Síndrome de Implante
Criterios Mayores Temperatura mayor a 38,3°C sin etiología infecciosa identificable
Rash eritrodérmico que comprometa más del 25% de la superficie corporal y no sea atribuible a un medicamento
Edema pulmonar no cardiogénico, manifestado por infiltrados pulmonares difusos consistentes con el diagnóstico e hipoxia
Criterios Menores Disfunción hepática con bilirrubinemia mayor a 2mg/dl o niveles de transaminasas dos veces el
valor normal
Insuficiencia renal (creatininemia sérica dos veces la basal)
Aumento de peso mayor a 2,5% el peso de baseAparición de 3 criterios mayores o 2 criterios mayores y 1 o más criterios menores dentro de las 48 horas previas y/o posteriores al implante, considerado como recuento de neutrófilos mayor o igual a 500 x mm3 dos días consecutivos.

604
Guías ClínicasSociedad Chilena de Trasplante
Seguimientoinmunidad:El control se efectuará basalmente, luego al día+30, +100, 6° mes, 12 meses, 18 meses, 24
meses post-TPH. Esto incluye subpoblaciones linfocitarias, blastogénesis, determinación de inmunoglobulinas. En caso de EICH y/o tratamiento inmunosupresor puede ser necesario prolongar el calendario de control hasta lograr inmunoreconstitución de acuerdo a criterios descritos en capítulo “Vacunas en el paciente sometido a Trasplante de Progenitores Hemato-poyéticos”.
En los pacientes sometidos a TPH alogénico, la administración de inmunoglobulinas es semanal (dosis: 400 mg/kg) hasta el día +30. Posteriormente, la indicación se determinará según los niveles sanguíneos del paciente, obtenidos en los controles programados según calendario.
Mantener profilaxis generales (ya descritas previamente). Se indicarán antibióticos durante procedimientos invasivos (profilaxis endocarditis) y profilaxis para agentes capsulados hasta la inmunoreconstitución.
En la literatura se recomienda el uso de mascarillas de alta eficiencia (N95) durante los trasla-dos y circulación intrahospitalaria de los pacientes con compromiso inmunitario.
SeguimientoaLargoPlazo:El seguimiento incluye además la evaluación por especialidades, de acuerdo a las compli-
caciones derivadas del acondicionamiento y tratamiento.
Orales:La mucositis en una complicación aguda muy frecuente, puede condicionar la aparición
de complicaciones crónicas. A menor edad, mayor es el riesgo de patología oral tal como ano-malías estructurales (hipoplasia raíz, agenesia, alteraciones faciales), caries dental, gingivitis, periodontitis. La EICH crónica a su vez contribuye con enantema, hiperqueratosis tipo liquen, úlceras y xerostomía. Esta última se ve agravada por la irradiación que afecta la producción de saliva al dañar las glándulas salivales.
Es necesario mantener una estricta higiene oral, evitar la xerostomía y programar evaluacio-nes dentales periódicas. Se recomienda evaluación por el dentista al menos una vez al año e idealmente cada 6 meses. Aquellos pacientes con EICH crónica y antecedente de radioterapia requieren una estricta vigilancia en busca de neoplasias orales (1,2, 3).
Oculares:Las complicaciones oftalmológicas más frecuentes son las cataratas, el síndrome de Sicca
y la retinopatía microvascular. Los principales factores de riesgo para las cataratas son la irra-diación (RT) y el uso de corticoides (uso prolongado y asociado a EICH crónico). Se ha logrado reducir su incidencia con el hiperfraccionamiento de la RT evitando el uso de dosis única. La retinopatía se asocia al uso combinado de RT y busulfan/ ciclosporina. Los hallazgos se revier-ten con la suspensión de la terapia inmunosupresora. La xeroftalmia requiere confirmación con test de Schrimer, siendo fundamental su pesquisa en pacientes con EICH crónico.
Se recomienda evaluación oftalmológica basal y luego anual incluyendo evaluación de agu-deza visual, fondo de ojo. El uso de lágrimas artificiales ha demostrado ser útil en el manejo sintomático del síndrome de sicca. (1, 2)

605
Trasplante de progenitoreshematopoyéticos en pediatría
Cardiovascular:Los principales factores de riesgo de compromiso cardiovascular son aquellos derivados
del tratamiento. La cardiotoxicidad de las antraciclinas se relaciona estrechamente con las dosis utilizadas (≥250-300 mg/m2), así como ciclofosfamida en dosis sobre 150 mg/kg, sobre-carga de fierro e irradiación torácica. Las manifestaciones clínicas son diversas: insuficiencia cardiaca congestiva, arritmias, cardiomiopatía, enfermedad valvular, reducción de la fracción de acortamiento.
Se recomienda estudio pre-trasplante y luego anual con ecocardiografía, evaluación de riesgo cardiovascular (clínica, test esfuerzo, ECG, estudio isotópico). (1, 4, 7)
Broncopulmonar:Las complicaciones no infecciosas se agrupan en obstructivas y restrictivas. Las primeras
resultan de la obstrucción de vía aérea pequeña, principalmente derivadas de EICH crónico. Existen entidades clínicas que permiten resumir este grupo de patologías:
• Síndrome Bronquiolitis obliterante: Se presenta entre 3-23 meses caracterizado por tos, disnea, obstrucción, infecciones repetidas. Los factores de riesgo son EICH crónico, MTX, esofagitis. La TAC muestra infiltrados en parche, atrapamiento aéreo y bronquiectasias. Se maneja con esteroides, inmunosupresión (MMF, azatioprina, CSA) pudiendo llegar in-cluso al trasplante pulmonar, con alta mortalidad. Se han publicado estudios de uso de macrólidos y corticoides inhalatorios.
• Neumonia idiopática: Se presenta con tos, disnea, hipoxemia, sin demostración etiológi-ca. Se evidencia la presencia de infiltrado intersticial en radiografía, clínicamente con pa-trón restrictivo como consecuencia de quimioterapia y radioterapia y/o manifestación de EICH.
• BOOP: Caracterizado por fiebre, tos, disnea. Asociado a EICH crónico. En TAC se eviden-cian opacidades nodulares, condensaciones. Puede responder a corticoides.
Se recomienda evaluación clínica y estudio de función pulmonar a los 6 meses, y luego anual-mente. Algunos expertos recomiendan cada 3-6 meses por 2 años, especialmente en EICH crónico. Se recomienda evitar el tabaco, vacunación según calendario y estatus inmunitario, la prevención de infecciones y profilaxis Pneumocystis jirovecii. (1, 5, 7)
Endocrinológicas:Los factores de riesgo más importantes para las disfunciones endocrinológicas son la radio
y quimioterapia, EICH crónico y terapia esteroidal.
• La disfunción tiroídea puede manifestarse con distintos patrones. Los desórdenes más frecuentes son hipotiroidismo primario, hipotiroidismo subclínico, síndrome eutiroídeo enfermo, autoinmune, carcinoma secundario. El riesgo es mayor que la población general por lo que es mandatorio el control, diagnóstico precoz.
• Síndrome Metabólico: En la literatura se ha reportado hasta un 30% de incidencia en pacien-tes sometidos a TPH. Por lo que se recomienda el seguimiento del perfil lipidico, medición de perímetro abdominal, presión arterial en forma seriada y estilos de vida saludable.
• Crecimiento: Irradiación (RT) el factor más importante, sin embargo, se ha publicado que el 80% alcanza talla final en rango de población normal. El déficit de hormona del creci-miento se ha estudiado, habiendo reportado que su uso beneficia a pacientes trasplantados menores, logrando alcanzar tallas esperadas, sin aumentar el riesgo de recaída.

606
Guías ClínicasSociedad Chilena de Trasplante
• Desarrollo puberal: La disfunción gonadal se ha relacionado con la RT y el uso de ciertas drogas como busulfan, induciendo hipogonadismo hipergonadotrófico, de recuperación muy rara. La fertilidad post-trasplante es muy baja y en caso de ocurrir existe mayor riesgo de parto prematuro y bajo peso al nacer.
Se recomienda evaluación de función tiroídea (TSH, T3, T4L) anualmente. Evaluación clínica y funcional gonadal en niñas, desde los 6 meses post trasplante y luego anual por endocri-nólogo infantil. En hombres, evaluación de función gonadal con FSH, LH y testosterona en caso de síntomas (disfunción eréctil, ausencia de líbido). Suspensión lenta y programada en caso de uso prolongado de corticoides, suplementación en caso de stress. Medición de peso y talla, velocidad de crecimiento (en caso de curva insuficiente evaluar tiroides y hormona del crecimiento). (1, 6, 8)
Esqueléticas-Óseas:La necrosis ósea avascular (NOA) y la osteoporosis son las complicaciones óseas tardías
más frecuentes. La NOA puede ser asintomática, ya que no producirá dolor hasta necrosar la médula ósea. Puede afectar huesos largos, pero también huesos de manos y pies, tobillos y mandíbula. Los factores de riesgo demostrados son la RCT, enfermedad de base, EICH agu-do/crónico y la mayor edad al momento del trasplante. La osteoporosis y osteopenia se ven agravadas por el uso prolongado de corticoides y por el hipogonadismo post-trasplante.
Se recomienda evaluación por traumatología y endocrinología, estilo de vida saludable, ejer-cicio, suplementación de calcio, densitometría anual para mujeres adultas, para pacientes con uso prolongado de corticoides e inhibidores de calcineurina. Además se recomienda evaluar función gonadal y tiroídea. (1, 9)
Hepáticas:El compromiso hepático y gastrointestinal se asocia principalmente a EICH. En caso de
alteración de la función hepática es necesario considerar EICH, hepatitis o sobrecarga de fie-rro. Debe definirse la presencia de síndrome de obstrucción sinusoidal, de infecciones como hepatitis B y C, o de siderosis. Es necesario considerar la realización de biopsia hepática para determinar el diagnóstico y dirigir la terapia.
Se recomienda estudio de función hepática y ferritina sérica anualmente, biopsia en caso de deterioro, RNM y función cardiaca en caso de siderosis. (1, 2)
Renales:Las complicaciones renales pueden ser inicialmente subclínicas, con reducción de la filtra-
ción glomerular. Sin embargo, se ha reportado nefropatía tardía post-trasplante en 17% a 28%. Los principales factores de riesgo son la radiación, especialmente la asociación de RT corpo-ral total e inmunosupresores, así como las drogas nefrotóxicas. La cistitis hemorrágica tardía puede presentarse en relación a infecciones (virales: ADV, BK) determinando en algunos casos disfunción vesical.
Se recomienda control anual clínico, presión arterial, función renal (creatinina, NU, clearance, examen de orina, proteinuria. (1,7)
SegundasNeoplasias:Se ha documentado la presencia de segundas neoplasias en pacientes adultos con antece-
dente de haber sido trasplantados 20 años antes. El mayor riesgo lo constituyen las neoplasias

607
Trasplante de progenitoreshematopoyéticos en pediatría
de piel, cabeza y cuello, tumores sólidos tales como tiroides y mama. Los factores de riesgo asociados más frecuentes son la radioterapia previa, RCT, quimioterapia, EICH crónica. Den-tro de las neoplasias hematológicas, se ha descrito la presencia de leucemia secundaria al uso de agentes alquilantes, antraciclinas, etopósido. El síndrome linfoproliferativo asociado a VEB puede presentarse precozmente, pero existen reportes de aparición tardíos en relación a do-nante alternativo, uso de ATG, DLT, EICH agudo severo.
Se recomienda un estilo de vida saludable, evitar la exposición exagerada al sol, el uso de pro-tectores UV, evaluación dental anual, screening con mamografía precoz si ha sido irradiada, auto examen (mamario, piel) y hemograma completo por 10 años. (1, 6, 10)
Neurológicas-SocialesLa irradiación de SNC y fármacos neurotóxicos son los principales factores de riesgo para
el daño cognitivo y neurológico post-trasplante. Se ha publicado que los pacientes trasplan-tados a mayor edad tienen menos secuelas que aquellos menores de 3 años. La ototoxicidad secundaria a quimioterapia debe ser pesquisada precozmente para que esto no influya en las evaluaciones neurológicas y cognitivas del paciente. Se ha relacionado con ciclofosfamida, thiotepa, cisplatino, carboplatino (quimioterapia previa o en el acondicionamiento).
Se recomienda una evaluación clínica al año, junto con reportes de conducta, escolaridad. En caso de síntomas, RNM (leucoencefalopatía, microangiopatía, atrofia cerebral, leucoencefalo-patía necrosante), audiometría basal y según antecedentes.
La reinserción social es fundamental, siendo necesario evaluar patrones de conducta, ansie-dad, vulnerabilidad, calidad de vida (trabajo, escolaridad, familia, actividad sexual si corres-ponde)
Se recomienda una evaluación basal, y a los 6 y 12 meses por un equipo de salud mental, apo-yo psicológico si lo requiere y asistente social. Evaluar la condición de los cuidadores o de la pareja en busca de riesgo y la disfunción familiar. (1, 11).

608
Guías ClínicasSociedad Chilena de Trasplante
3.10inmunoreconstituciónenelpacientesometiDoatrasplanteDeprogenitoresHematopoyéticos
La restauración de la hematopoyesis, mediante la transfusión de médula ósea o de precur-sores hematopoyéticos, se conoce como Trasplante de Médula Ósea (TMO) y constituye uno de los procedimientos más eficaces en el tratamiento de diversas enfermedades hematológi-cas, inmunológicas, de depósito y neoplásicas. Luego del TPH, los receptores se caracterizan por atravesar un período de inmunodeficiencia de duración variable. Es en este tiempo en que el número absoluto y las proporciones de las distintas subpoblaciones linfocitarias se encuen-tran disminuidas. Durante este lapso, ocurren infecciones bacterianas, virales, fúngicas que comprometen la vida del receptor. Por esta razón, el análisis cualitativo y cuantitativo de los linfocitos así como el estudio funcional de la respuesta inmune, ofrece la oportunidad de eva-luar el proceso de inmunoreconstitución y determinar si esta ocurre en forma normal o no.
Después de la quimioterapia y radioterapia pre-TPH toda la hematopoyesis normal del receptor, la respuesta inmune celular y la mayoría de la respuesta inmune humoral son eliminadas. Así, cuando se realiza un TPH, la reconstitución de la MO contempla dos procesos diferentes. Por un lado, está la recuperación cuantitativa o numérica de los elementos celulares y por otro, la recupe-ración funcional que indica el grado de interacción y maduración de los diferentes componentes celulares. Aunque la aparición de las plaquetas y los neutrófilos a menudo son considerados bue-nos marcadores de la recuperación hematopoyética después de los tratamientos de quimioterapia y TPH, esta no contempla un aspecto que es fundamental en la recuperación de la médula ósea, la reconstitución del sistema inmune. Este es un aspecto de suma importancia en la recuperación post TPH del receptor, ya que la reconstitución funcional del sistema inmune y sus distintos com-ponentes celulares y humorales ocurre en forma gradual y puede tardar un año a dos años.
La inmunoreconstitución involucra varios componentes y etapas del sistema inmune los cua-les incluyen: a) aparición de linfocitos B funcionales, b) desarrollo tímico y extratímico de las diferentes poblaciones de linfocitos T efectores, c) reconstitución de las células efectoras citotóxicas CD8+ y de los linfocitos NK y d) presentación antigénica eficiente para reconstituir nuevamente el repertorio y memoria inmune. Este restablecimiento de la función inmune no es meramente experimental, ya que tiene implicaciones clínicas directas. Por un lado, se en-cuentra el estado de inmunodeficiencia en el cual queda el receptor lo cual tiene consecuencia la aparición de infecciones, aspecto que constituye unas de las mayores causas de morbi mor-talidad post trasplante. Por otro lado, la aparición de la EICH ag y EICH cr esta directamente relacionada con el restablecimiento del sistema inmune constituyéndose también en una de las mayores causas de morbimortalidad en estos pacientes.
Los estudios de inmunoreconstitución en general incluyen la medición prospectiva del por-centaje y número absoluto de los siguientes parámetros: 1) linfocitos T Totales CD3+, 2) Lin-focitos T Helper CD4+, 3) Linfocitos T Supresores CD8+, 4) Linfocitos B CD19+, 5) Linfocitos NK CD56+, 6) índice CD4/CD8, 7) Linfocitos T Naive o vírgenes CD45RA+ y 8) Linfocitos T de Memoria CD45RO+. Un parte importante de estudio de inmunoreconstitución es la determi-nación de la respuesta inmune funcional. Para ello también se determina la proliferación de los linfocitos frente a estímulos policlonales como por ejemplo PHA o ConA lo cual nos dará una idea de la funcionalidad del sistema inmune.
Es importante destacar que la recuperación de las diferentes subpoblaciones no sucede en for-ma simultánea, sino más bien cada subpoblación linfocitaria en particular tiene su propia ci-nética de reconstitución. La recuperación del número absoluto de los linfocitos T Totales CD3+ ocurre aproximadamente a las 12 semanas. La normalización de los linfocitos T Supresores CD8+ se normalizan mas rápido que los Linfocitos T Helper CD4+. Los linfocitos T D8+ sue-

609
Trasplante de progenitoreshematopoyéticos en pediatría
len alcanzar valores normales a los 4 meses post trasplante mientras los linfocitos CD4+ aun siguen bajos a los 6 meses post-trasplante. Esta rápida normalización de los linfocitos CD8+ conjuntamente con una lenta recuperación de los linfocitos CD4+ resulta en una inversión del índice CD4/CD8 hasta por lo menos 6-12 meses post trasplante. El número de linfocitos B CD19+ alcanzan niveles normales después de los 2 meses post TPH aunque el análisis de los genes de las cadenas pesadas de estos linfocitos indican que la mayoría corresponderían a linfocitos B inmaduros sugiriendo que ocurre una maduración progresiva de los linfocitos B en el tiempo. Los linfocitos NK aparecen precozmente post trasplante y durante el primer mes representan la mayor población linfoide presente en sangre periférica. Por ultimo, los estudios funcionales de respuesta proliferativa linfocitaria revelan que la respuesta inmune celular se normaliza aproximadamente entre los 9-12 meses post trasplante.
3.11vacunas en el paciente sometiDo a trasplante De progenitoresHematopoyéticos
El objetivo de la inmunización activa en el paciente sometido a trasplante de progenitores hematopoyéticos es disminuir la morbilidad y la mortalidad de las enfermedades prevenibles (1, 2, 3) por vacunas que estén recomendadas en pacientes inmunosuprimidos y que estén disponibles a nivel nacional.
Para determinar las vacunas que se deben incluir en el programa de inmunización del pa-ciente sometido a trasplante de progenitores hematopoyéticos se debe considerar el riesgo y severidad de las infecciones que se pueden prevenir con vacunas (1):
a) Las infecciones por Neumococo, Haemophilus influenzae B (HiB), Virus varicella zoster (VZV) y Virus Influenza son más frecuentes y/o más severas en los pacientes trasplantados que en la población general.
b) Las enfermedades infecciosas, incluyendo el tétano, difteria, poliomielitis y hepatitis B no son más frecuentes en los pacientes trasplantados, pero las vacunas para estos microorga-nismos están recomendadas para proteger a la población general.
c) Las infecciones prevalentes en áreas de residencia específica o para viajeros
Otro aspecto importante son los riesgos de efectos colaterales asociados a las vacunas. Las que contienen microorganismos inactivos, antígenos o subunidades del microorganismo, son seguras y no conllevan más riesgos que los que tienen los individuos sanos. Las vacunas que contienen microorganismos vivos tienen el riesgo de causar la enfermedad en pacientes in-munosuprimidos por lo que no deberían utilizarse (BCG, Polio oral) y sólo se podría consi-derar en algunas circunstancias (sarampión, varicela, rubéola). Se puede estimar reemplazar la vacuna polio oral por la vacuna polio inactivada (IPV), ya sea como vacuna individual o contenida en la vacuna combinada hexavalente
La respuesta a la vacunación es usualmente muy baja en los primeros 6 meses post- trasplante, comenzando a manifestarse entre los 6 y 12 meses posteriores. Se espera una respuesta com-pleta (inmunocompetencia) después de los 2 años del trasplante, excepto si hay presencia de enfermedad injerto contra huésped crónica (1).
Los pacientes que están cursando EICH y están con tratamiento inmunosupresor no deben re-cibir vacunas con microorganismos vivos, pero no hay evidencia que sugiera que las vacunas inactivadas exacerben la EICH cr. Sin embargo la información es variable en relación con la respuesta inmunitaria que pueda lograrse.

610
Guías ClínicasSociedad Chilena de Trasplante
Otra alternativa posible para disminuir el riesgo de enfermedad infecciosa en el paciente so-metido a trasplante, es reducir la probabilidad de exposición. Esto se puede lograr con la vacunación, por ejemplo, de los familiares y equipo de salud contra el virus de la influenza. En algunos países del Reino Unido, se recomienda vacunar a todo el equipo de salud sero-negativo contra la varicela, aunque esto puede condicionar la diseminación y transmisión de esta enfermedad a los contactos vulnerables (si esto ocurre, éstos deberían ser tratados con aci-clovir). La inmunización de la familia y equipo de salud supone más beneficio que riesgo, sin embargo, la vacuna viva poliovirus no debería ser usada en los familiares ni en el equipo de salud que atiende a pacientes sometidos a trasplante de progenitores hematopoyéticos (1).
ConsideracionesparavacunaciónefectivayseguraPacientes con trasplante autólogo: Se podría programar la re-inmunización un año post
trasplante con los criterios abajo enumerados.
• Pacientes con trasplante alogénico serían evaluables para iniciar la re- inmunización a los 6 – 12 meses post trasplante, sin EICH y sin terapia inmunosupresora. Con un periodo mínimo de 2 meses sin haber recibido inmunoglobulina endovenosa y con los siguientes parámetros(4):
a) Recuento absoluto de CD3 CD4 mayor de 400
b) Recuento absoluto CD19 mayor de 200
c) Recuento absoluto de linfocitos mayor de 1000
d) Niveles de IgG normales para la edad
• Todo paciente trasplantado debe recibir la vacuna contra la influenza estacional desde los 6 meses post trasplante (4). Independiente del estado de inmunoreconstitución. En los pa-cientes menores de 9 años la primera vez debe recibir 2 dosis con un mes de separación entre ellas (1,3).
• El inicio de la re – inmunización está fijado para 12 meses post trasplante pero va a depen-der de los criterios mencionados en el texto anterior (1,2,4)
• Pacientes mayores de 2 años deben recibir la vacuna polisacárida (PPV23), la vacuna hep-tavalente no provee protección efectiva para estos pacientes. No se debe dar la vacuna polisacárida en menores de 2 años (1,5)
La vacuna tres vírica debería ser administrada después de 24 meses post trasplante. No se debe administrar a pacientes con disfunción inmune o en embarazadas. Se puede considerar repetir la dosis a los 6 o 12 meses (1,2).
Esquema recomendado en TPH en niños menores de 2 años
VacunaMeses post TPH
6 12 14 18 24Hexavalente (DTPa, HiB,IPV, HB) + + +Hepatitis (A y B) + + +Neumocócica conjugada + + +Influenza +Tres vírica +

611
Trasplante de progenitoreshematopoyéticos en pediatría
Esquema recomendado en TPH en niños mayores de 2 años
VacunaMeses post TPH
6 12 14 18 24Hexavalente ( DTPa, HiB,IPV, HB) + + +Hepatitis (A y B) + + +Pneumo23 (polisacárida) + + +Influenza +Tres vírica +
3.12acreDitaciónLa evaluación y control de la calidad en la atención de pacientes trasplantados es una pre-
ocupación en todo el mundo (1), en 1994 la International Society of Cell Therapy y la American Society of Blood and Marrow Transplant se reunieron para unificar los estándares de calidad definidos por ambas instituciones y crearon la Foundation for Accreditation of Cell Therapy (FACT) (2).
FACT evalúa y certifica que dichos estándares han sido logrados en las distintas unidades; en 1998 por primera vez, un programa de trasplante acreditó el cumplimiento de los estándares de calidad (2).
En Latinoamérica ningún programa de trasplantes ha acreditado los estándares de calidad FACT (3,4).
En Chile, el artículo 11 de la Ley N°19.937 de Autoridad Sanitaria, establece la importancia primordial que tiene la calidad en la atención en salud. (5) El Ministerio de Salud de Chile ha desarrollado un sistema de acreditación para unidades clínicas de TPH basado en los estánda-res de FACT. Con ese instrumento evaluó y acreditó las instalaciones de la UTMO al momento de su inauguración y antes de iniciar la actividad clínica, en 1999. (6)
Es necesario que todas las unidades de TPH en el país pasen por esta acreditación ministerial antes de iniciar su actividad para asegurar las condiciones mínimas de calidad de las insta-laciones y procedimientos. Del mismo modo es necesario reevaluar periódicamente que esos estándares se mantienen, se recomienda que cada 2 a 3 años las unidades deban someterse nuevamente a un proceso de acreditación.
Se debe incentivar que las unidades de TPH no sólo acrediten a nivel nacional sino que tam-bién a nivel internacional, tanto en sus áreas clínicas como de recolección, procesamiento y almacenamiento celular.
Los procesos de acreditación miden las condiciones necesarias para seguridad de los pacien-tes, sin embargo lo más importante son los resultados clínicos obtenidos que dan cuenta, ade-más de la calidad, de la estructura física y de los procedimientos, de la calidad de la atención de salud integral. (7) Es necesario implementar evaluaciones y reportes anuales o semestrales a la autoridad sanitaria, de resultados clínicos como MRT ajustado por riesgo, mortalidad total, tasa de recaída, tasa de infecciones, tasa de desarrollo de EICH u otros. Con estos datos se pueden diagnosticar problemas precozmente y así diseñar e implementar medidas para mejorar oportunamente.

612
Guías ClínicasSociedad Chilena de Trasplante
gloSario de tÉrminoS
A-TPH Trasplante autólogo
Alo-TPH Trasplante alogénico
ADV Adenovirus
AF Anemia de Fanconi
AMS Aplasia Medular Severa
AP Ambiente Protegido
ARA-C Citarabina
ATG Timoglobulina
BCG Bacilo Calmette Guérin de la vacuna anti tuberculosa
ABF Blackfan Diamond
BCNU Carmustina
BOOP Bronquiolitis obliterante con neumonía en organización
Bu Busulfan
CB Crisis Blástica
CFU-GM Células formadoras de colonias
CMN Células Mononucleares
CMV Citomegalovirus
CNT Células Nucleadas Totales
Cy Ciclofosfamida
CSA Ciclosporina
D En Desarrollo
DLI Infusiones de linfocitos del donante
DLT Depleción de Linfocitos T
DnE Donante no emparentado
DMSO Dimetilsulfóxido
E Estándar o Rutina
EBMT European Group for Blood and Marrow Transplantation
EH Enfermedad de Hodgkin
EICH Enfermedad de Injerto contra Huésped

613
Trasplante de progenitoreshematopoyéticos en pediatría
EICH ag Enfermedad de Injerto contra Huésped Agudo
EICH cr Enfermedad de Injerto contra Huésped Crónico
EVOH Enfermedad veno-oclusiva
FA Fase Acelerada
FACT Foundation for Accreditation of cell Therapy
FC Fase Crónica
Flu Fludarabina
G-CSF Factor estimulador de colonias granulocíticas
GGIV Gamaglobulina intravenosa
GGT Gamma Glutamil Transferasa
GNR Generalmente No Recomendado
GOT Transaminasa Glutámico Oxalacética
GPT Transaminasa GLutámico-Pirúvica
Gy Gray
GR Glóbulos Rojos
HEPA Filtros de partículas en el aire de alta eficiencia
HB Hemoglobina
HLA Antígenos Leucocitarios Humanos
HLCM Hospital Luis Calvo Mackenna
HTLV Virus humano asociado a linfoma T
IFI Infección Fúngica Invasora (criterios)
ICT Irradiación corporal total
JACIE Joint Accreditation Committee – ISCT and EBMT
LBA Lavado bronqueoalveolar
LCR Líquido cefalorraquídeo
LDH Deshidrogenasa Láctica
LLA Leucemia Linfoblástica Aguda
LLLT low-level laser therapy
LMA Leucemia Mieloide Aguda
LMC Leucemia Mieloide Crónica
LMMJ Leucemia Mielomonocitica Juvenil

614
Guías ClínicasSociedad Chilena de Trasplante
LNH Linfoma No Hodgkin
MAT Microangiopatía Trombótica
MD Donante Compatible
MDDnE Donante no emparentado compatible
MD SCU Donante compatible de Sangre de cordón umbilical de donante no emparen-tado
MDfa Donante compatible familiar (no hermano)
MMD Mismatch donor; Donante parcialmente compatible
MEL Melfalan
MMF Micofenolato
MMR Mismatch Related
MO Médula ósea
MR Match Related
MRT Mortalidad Relacionada al Trasplante
MSD (Match Sibling Donor), Donante Hermano HLA idéntico
MTX Metrotrexato
NK Natural Killer
NOA Necrosis ósea avascular
OT Opción Terapéutica
OMS Organización Mundial de la Salud
PCR Reacción de polimerasa en cadena
PET Positron Emission Tomography
PGE1 Prostaglandina E1
PH Progenitores Hematopoyéticos
PHMO Progenitores hematopoyéticos de médula ósea
PHSCU Progenitores hematopoyéticos de sangre de cordón umbilical
PHSP Progenitores hematopoyéticos en sangre periférica
PINDA Programa Infantil Nacional de Drogas Antineoplásicas
PTLD Trastorno linfoproliferativo post trasplante
RAN Recuento Absoluto de Neutrófilos
RC Remisión Completa

615
Trasplante de progenitoreshematopoyéticos en pediatría
RNM Resonancia Nuclear Magnética
RT Irradiación
SCID Inmunodeficiencia Primaria Severa
SCU Sangre de Cordón Umbilical
SCU DnE Sangre de cordón umbilical de donante no emparentado
SP Sangre periférica
SLE Sobrevida Libre de Eventos
SMD Síndrome Mielodisplástico
SNC Sistema Nervioso Central
ST Sobrevida total
Status Estado
TKI Inhibidores de tirosin kinasa
TAC Tomografía Axial Computada
TC Terapia celular
TT Tiotepa
TMO Trasplante de Médula Osea
TPH Trasplante de Progenitores Hematopoyéticos
UTPH Unidad de Trasplante de Progenitores Hematopoyéticos
VEB Virus Epstein Barr
VIH Virus de Inmunodeficiencia Humana
VP-16 Etopósido
WAS Síndrome de Wiskott-Aldrich

616
Guías ClínicasSociedad Chilena de Trasplante
BiBliograFía
Descripciónyepidemiologíadelproblemadesalud:1. Minsal-Chile:DesarrollodelaoncologíapediátricaenChile.En:cáncerinfantilenChile.Santiago:editadopor
Minsal,2001;61-9.Disponibleenwww.minsal.cl(consultadoel05/03/08).
2. CampbellM.,SalgadoC.,QuintanaJ.,BeckerA.,VargasL.,CabreraMA.,etalMejoríaenelpronósticodelaleucemia linfoblásticaagudaenniñosdeunpaísendesarrollo: resultadosdelprotocolonacionalchilenoPINDA87.RevChilPediatr1999;70:405-414.
3. VargasL.Avancesenel tratamientodelcáncer infantilenChile.Diezañosdelprograma infantilnacionaldedrogas(PINDA).RevChilPediatr1998;69:270-275.
4. VargasL.Cáncerenpediatría.Aspectosgenerales.RevChilPediatr2000;71:283-95.
5. Barriga F., Baeza R., Pereira J., Besa P., Caldumbide I., Medel M.Trasplante de médula ósea en pacientespediátricos.RevChilPediatr1999;70:194-200.
6. PalmaJ.,MossoC.,ParisC.,KingA.,AdvisP.,BeckerA.,etal.Experienciainicialdelcomitédetrasplantedeprogenitoreshematopoyéticos,PINDA.Octubre1999-Marzo2004.ResúmenesdelXLIVcongresochilenodepediatría.RevChilPediatr2004;75:565-641.
RequerimientosdeestructurafísicadeUTPH1. GuíasdePlanificaciónyDiseñodelServiciodeOncologíaenAltaComplejidad,MinisteriodeSalud2000.Chile.
RegistroPropiedadIntelectualInscripciónN°118.506.ISBN956-7711-22-4.
2. Revisión de Evidencia Científica y Recomendaciones. El manejo ambiental de pacientesTransplantados deMédulaÓsea.SerieCuadernosdeRedesN°21,2009.SubsecretaríadeRedesAsistenciales,MinisteriodeSaluddeChile.
3. SehulsterL.,ChinnRY.;CDC;HICPAC.Guidelines forenvironmental infectioncontrol inhealth-care facilities.RecommendationsofCDCand theHealthcare InfectionControlPracticesAdvisoryCommittee(HICPAC).MMWRRecommRep2003;52:1-42.
4. Siegel JD., Rhinehart E., Jackson M., Chiarello L., and the Healthcare Infection Control Practices AdvisoryCommittee. 2007 Guideline for Isolation Precautions: Prevention Transmission of infectious Agents inHealthcareSettings.Disponibleen:http://www.cdc.gov/ncidod/dhqp/pdf/isolation2007.pdf
5. DykewiczC.Hospital InfectionControl inHematopoieticStemCellTransplantRecipients;Emerging InfectDis2001;7:263-267.
6. CentersforDiseaseControlandPrevention;InfectiousDiseaseSocietyofAmerica;AmericanSocietyofBloodandMarrowTransplantation.Guidelinesforpreventingopportunisticinfectionsamonghematopoieticstemcelltransplantrecipients.MMWRRecommRep2000;49:1-125.
Definicióntiposdedonante1. PrasadVK.,KernanNA.,HellerG.,O’ReillyRJ.,YangSY.DNAtypingforHLA-AandHLA-Bidentifiesdisparities
between patients and unrelated donors matched by HLA-A and HLA-B serology and HLA-DRB1. Blood1999;93:399–409.
2. SpeiserDE.,TiercyJM.,RuferN.,GrundschoberC.,GratwohlA.,ChapuisB.,etal.HighresolutionHLAmatchingassociated with decreased mortality after unrelated bone marrow transplantation. Blood 1996;87: 4455–4462.
3. FlomenbergN.,Baxter-LoweLA.,ConferD.,Fernandez-VinaM.,FilipovichA.,HorowitzM.,etal.ImpactofHLAclassIandclassIIhighresolutionmatchingonoutcomesofunrelateddonorbonemarrowtransplantation:HLA-Cmismatchingisassociatedwithastrongadverseeffectontransplantationoutcome.Blood2004;104:1923–1930.
4. ChalandonY.,TiercyJM.,SchanzU.,GungorT.,SegerR.,HalterJ.,etal. Impactofhigh-resolutionmatching inallogeneicunrelateddonorstemcelltransplantationinSwitzerland.BoneMarrowTransplant2006;37:909–916.
5. Yakoub-Agha I., Mesnil F., Kuentz M., Boiron JM., Ifrah N., Milpied N., et al. Allogeneic marrow stem-celltransplantationfromhumanleukocyteantigen-identicalsiblingsversushumanleukocyteantigen-allelicmatchedunrelateddonors(10/10)inpatientswithstandard-riskhematologicmalignancy:aprospectivestudyfromtheFrenchSocietyofBoneMarrowTransplantationandCellTherapy.JClinOncol2006;24:5695–5702.

617
Trasplante de progenitoreshematopoyéticos en pediatría
6. PetersdorfEW.HLAmatchinginallogeneicstemcelltransplantation.CurrOpinHematol2004;11:386–391.
7. Sedlácek P., Formánková R., Keslová P., Srámková L., Hubácek P., Król L., et al. Low mortality of childrenundergoinghematopoieticstemcelltransplantationfrom7to8/10humanleukocyteantigenallele-matchedunrelateddonorswiththeuseofantithymocyteglobulin.BoneMarrowTransplant2006;38:745–750.
8. KollmanC.,HoweCW.,AnasettiC.,AntinJH.,DaviesSM.,FilipovichAH.,etal.Donorcharacteristicsasriskfactorsinrecipientsaftertransplantationofbonemarrowfromunrelateddonors:theeffectofdonorage.Blood2001;98:2043–2051.
9. LjungmanP.,BrandR.,EinseleH.,FrassoniF.,NiederwieserD.,CordonnierC.DonorCMVserologicstatusandoutcomeofCMV-seropositiverecipientsafterunrelateddonorstemcelltransplantation:anEBMTmegafileanalysis.Blood2003;102:4255–4260.
10. Ljungman P., Perez-Bercoff L., Jonsson J., Avetisyan G., Sparrelid E., Aschan J., et al. Risk factors for thedevelopmentofcytomegalovirusdiseaseafterallogeneicstemcelltransplantation.Haematologica2006;91:78–83.
11. EapenM.,RubinsteinP.,ZhangMJ.,CamittaBM.,StevensC.,CairoMS.,etal.Comparablelong-termsurvivalafterunrelatedandHLA-matchedsiblingdonorhematopoieticstemcelltransplantationsforacuteleukemiainchildrenyoungerthan18months.JClinOncol2006;24:145–151.
12. DahlkeJ.,KrögerN.,ZabelinaT.,AyukF.,FehseN.,WolschkeC.,etal.Comparable results inpatientswithacutelymphoblasticleukemiaafterrelatedandunrelatedstemcelltransplantation.BoneMarrowTransplant2006;37:155–163.
13. Hambach L., Spierings E., Goulmy E. Risk assessment in haematopoietic stem cell transplantation: minorhistocompatibilityantigens.BestPractResClinHaematol2007;20:171–187.
14. BettensF.,PasswegJ.,GratwohlA.,ChalandonY.,HelgC.,ChapuisB.,etal.AssociationofTNFdandIL-10polymorphismswithmortalityinunrelatedhematopoieticstemcelltransplantation.Transplantation2006;81:1261–1267.
15. DickinsonAM.,MiddletonPG.BeyondtheHLAtypingage:geneticpolymorphismspredictingtransplantoutcome.BloodRev2005;19:333–340.
16. MullighanCG.,PetersdorfEW.Genomicpolymorphismandallogeneichematopoietictransplantationoutcome.BiolBloodMarrowTransplant2006;12:19–27.
IndicacionesdeTrasplantedeCélulasProgenitorasHematopoyéticasenPediatría1. SchmitzN.,GratwohlA.,GoldmnJM.Allogeneicandautologoustransplantationforhaematologicaldiseases,solid
tumoursandimmunedisorders:currentpracticeinEuropein1996andproposalsforanoperationalclassification.Accreditation Sub-Committee of the European Group for Blood and MarrowTransplantation (EBMT). BoneMarrowTransplant1996:17,471-477.
2. Urbano-Ispizua A., Schmitz N., de Witte T., Frassoni F., Rosti G., Schrezenmeier H., et al. Allogeneic andautologoustrasplantationforhaematologicaldiseases,solidtumoursandimmunedisorders:definitionandcurrentpracticeinEurope.BoneMarrowTransplant2002:29,639-646.
3. Ljungman P., Urbano-Ispizua A., Cavazzana-Calvo M., DemirerT., Dini G., Einsele H., et al. Allogeneic andautologoustrasplantationforhaematologicaldiseases,solidtumoursandimmunedisorders:definitionandcurrentpracticeinEurope.BoneMarrowTransplant2006:37,439-449.
4. LjungmanP.,BregniM.,BruneM.,CornelissenJ.,WitteTD.,DiniG.,etal.Allogeneicandautologoustransplantationfor haematological diseases, solid tumour and immune disorders: current practice in Europe 2009. BoneMarrowTransplantadvanceonlinepublication,6July2009;doi:10.1038/bmt.2009.141.
5. KimHT.Cumulativeincidenceincompetingrisksdataandcompetingrisksregressionanalysis.Clincancerres2007;13:559-565.
6. Matthes-MartinS.,PötschgerU.,BergmannK.,FrommletF.,BrannathW.,BauerP.,etal.Risk-adjustedoutcomemeasurementinpediatricallogeneicstemcelltransplantation.BiolBloodMarrowTransplant2008;14:335-343.
7. JointAccreditationCommittee.EBMTT-EuroISHAGE(JACIE)AccreditationManual(www.jacie.org).
8. HandgretingerR.,KurtzbergJ.,EglerRM.Indicationanddonorselectionsforallogeneicstemcelltransplantationinchildrenwithhematologicmalignancies.PediatrClinNAm2008;55:71-96.
9. DufourC.,SvahnJ.Fanconianemia:newstrategies.BoneMarrowTransplant2008;41:S90-S95.
10. OchsHD.,FilipovichAH.,VeysP.,CowanMJ.,KapoorN.Wiskott-Aldrichsyndrome:Diagnosis,clinicalandlaboratorymanifestationsandtreatment.BiolBloodMarrowTransplant2009;15:84-90.

618
Guías ClínicasSociedad Chilena de Trasplante
11. Rovelli AM.The controversial and changing role of haematopoietic cell transplantation for lysosomal storagedisorders:anupdate.BoneMarrowTransplant2008;41:S87-S89.
12. DriessenGJ.,GerritsenEJ.,FischerA.,FasthA.,HopWC.,VeysP.,etal.Long-termoutcomeofhaematopoieticstemcell transplantation inautosomal recessiveosteopetrosis:anEBMT report.BoneMarrowTransplant2003;32:657-663.
IngresoalProgramadeTPH1. AppelbaumF.,FormanS.,NegrinR.,BlumeK.Thoma´sHematopoieticCellTransplantation.Ed.:Wiley-Blackwell,
FourthEdition.,USA;2009;p.445-460.Revisarejemploabajo.
2. SacchiN.,CosteasP.,HartwellL.,HurleyCK.,RaffouxC.,RosenmayrA.,etal.Haematopoieticstemcelldonorregistries:WorldMarrowDonorAssociationrecommendationsforevaluationofdonorhealth.BoneMarrowTransplant2008;42:9-14
3. CarrerasE,BrunetM,SierraJ,Urbans-IspizvaA.ManualdeTrasplanteHemopoyético.EditorialAntares,España,(1998)3,119-36.
4. BurtR,DeegH,LothianS,SantosG.BoneMarrowTransplantation.LandesBioscience.Vademecum(1996)1,3;14-21
5. ProtocoloTrasplantehaploidénticoutilizandodeplecióndecélulasTcomotratamientodepacientesconpatologíaoncohematológicademuyaltoriesgo.REFSCT.PINDA-HLCM.4,19-20.
6. Guidelines for the Blood Transfusion Services in the United Kingdom 7th Edition 2005. Chapter 2, p 252-276, published BT TSO. Disponible en: http://www.oficialdocument/other/0117033715/0117033715asp(07.07.200)
7. Bone Marrow harvesting, Labeling and Transport. Policies Procedures and Clinical Guidelines Manual. TheChildren`sMemorialHospital.StemcellProgram.,Chicago,IL,USA.
GuíaparalaRecoleccióndeProgenitoresHematopoyéticos1. Internationalstandardsforcordbloodcollection,processing,testing,banking,selectionandrelease.NETCORD,
Fact.Thirdedition,December2006.Disponibleenhttp://www.factwebsite.org(consulta:07.07.2009)
2. NationalMarrowDonorProgram.Disponibleen:http://www.marrow.org/JOIN/Med_Guidelines_Join/index.html.(Consulta:07julio2009).
3. Manual de Procedimientos Unidad de Transplante de Médula ósea Pediátrica.OPD Hospitales Civiles deGuadalajara.HospitalJuanI.Menchaca.DivisióndePediatría.ServiciodeHemato-OncologíaPediatría.
4. CassensU.,MomkvistPH.,ZuehlsdorfM.,MohrM.,KienastJ.,BerdelWE.,etal.Kineticsofstandardizedlargevolumeleukapheresis(LVL)inpatientsdonotshowarecruitmentphenomenonofperipheralbloodprogenitorcells(PBPC).BoneMarrowTransplant;2001:28:13-20.
5. BasquieraAL.,AbichainP.,DamonteJC.,RicchiB.,SturichAG.,PalazzoED.ThenumberofCD34+Cells inperipheralbloodasapredictoroftheCD34+yieldinpatientsgoingtoautologousstemcelltransplantation.JClinApher2006;21:92-95.
6. MartinoM.,Callea I.,CondemiA.,DattolaA., IrreraG.,MarcuccioD.,etal.Predictive factors thataffect themobilizationofCD34(+)cellsinhealthydonorstreatedwithrecombinantgranulocytecolony-stimulatingfactor(G-CSF).JClinApher2006;21:169-175.
7. TherapeuticApheresis:Aphysician´sHandbook.Firstedition,Firstedition,AABBandAFA.2005EditorBruceMcLeod,MD..
8. SchlenkeP,FrohnC,SteinhardtMM,KirchnerH,KlüterH.Clinicallyrelevanthypokalaemia,hypocalcaemia,andlossofHemoglobinandplateletsduringStemCellApheresis.JClinApher2000;15:230-235.
9. Perseghin P., Confalonieri G., Buscemi F., Dassi M., Pogliani E., Pioltelli P. Electrolyte monitoring in patientsundergoingperipheralbloodstemcellcollection.JClinApher1999;14:14-17.
10. HarrisDT.,SchumacherMJ.,RychlikS.,BoothA.,AcevedoA.,RubinsteinP.,etal.Collection,separationandcryopreservationofumbilicalcordbloodforuseintransplantation.BoneMarrowTransplant1994:13;135-143.
Acondicionamiento1.-ApperlyJ.,CarrerasE.,GluckmanE.,GratwohlA.,MassziT.TheEBMTHandbook.5thEdition.Haematopoietic
StemCellTransplantation.2008capítulo6,p128-145,EBMT-ESH,forumserviceeditore,Genoa,Italy.

619
Trasplante de progenitoreshematopoyéticos en pediatría
2.-AppelbaumF.,FormanS.,NegrinR.,BlumeK.Thomas’HematopoieticCellTransplantation.FourthEdition.Wiley-Blackwell.UK,2009capítulos21,p289-315,22,p316-332,23,p333-350.
3.- Pulsipher MA., Boucher KM.,Wall D., Frangoul H., Duval M., Goyal RK., et al. Reduced-intensity allogeneictransplantation inpediatricpatients ineligible formyeloablative therapy: resultsof thePediatricBloodandMarrowTransplantConsortiumStudyONC0313.Blood2009;114:1429-36.
4.-DaviesJ.,GuinanEC.Anupdateonthemanagementofsevereidiopathicaplasticanaemiainchildren.BritishJournalHaematology2007;136:549-564.
5.-DufourC.,SvahnJ.Fanconianemia:newstrategies.BoneMarrowTransplant2008;41:S90-S95.
ManejodelaEnfermedadInjertoversusHuésped1. BillinghamRE.Thebiologyofgraft-versus-hostreactions.AcademicPressHarveyLecture:NewYork,1966-1967;
62:21-78..
2. Filipovich AH., Weisdorf D., Pavletic S., Socie G., Wingard JR., Lee SJ., et al. National Institutes of Healthconsensusdevelopmentprojectoncriteriaforclinicaltrialsinchronicgraft-versus-hostdisease:I.Diagnosisandstagingworkinggroupreport.BiolBloodMarrowTransplant2005;11:945-956.
3. PrzepiorkaD.,WeisdorfD.,MartinP.,KlingemannHG.,BeattyP.,HowsJ.,etal.1994ConsensusconferenceonacuteGvHDgrading.BoneMarrowTransplant1995;15:825-828.
4. Ball LM., Egeler RM.; EBMT Paediatric Working Party. Acute GvHD: pathogenesis and classification.. BoneMarrowTransplant2008;41:S58-S64.
5. VanLintMT.,UderzoC.,LocasciulliA.,MajolinoI.,SciméR.,LocatelliF.,etal.Earlytreatmentofacutegraft-versus-hostdiseasewithhigh-or low-dose6methylprednisolone:amulticenterrandomizedtrial fromtheItalianGroupforBoneMarrowTransplantation.Blood1998;92:2288-2293.
6. Van Lint MT., Milone G., Leotta S., Uderzo C., Scimé R., Dallorso S., et al.Treatment of acute graft-versus-host-diseasewithprednisolone:significantsurvivaladvantageforday+5respondersandnoadvantagefornonrespondersreceivinganti-thymocyteglobulin.Blood2006;107:4177-4781.
7. AntinJH.,ChenAR.,CourielDR.,HoVT.,NashRA.,WeisdorfD.Novelapproaches to the therapyofsteroidresistantacutegraft-versus-host-disease.BiolBloodMarrowTransplant2004;10:655-668.
8. JagasiaM.,GigliaJ.,ChinratanalabW.,DixonS.,ChenH.,FrangoulH.,etal.Incidenceandoutcomeofchronicgraft-versus-hostdiseaseusingNationalInstitutesofHealthconsensuscriteria.BiolBloodMarrowTransplant2007;13:1207-1215.
9. Zecca M., Prete A., Rondelli R., Lanino E., Balduzzi A., Messina C., et al. Chronic graft-versus-host disease inchildren:incidence,riskfactorsandimpactonoutcome.Blood2002;100:1192-1200.
10. RizzoJD.,WingardJR.,TichelliA.,LeeSJ.,VanLintMT.,BurnsLJ.,etal.Recommendedscreeningandpreventivepractices for long-term survivors after haematopoietic cell transplantation: joint recommendations of theEuropeanGroupforBloodandMarrowTransplantation,CentreforInternationalBloodandMarrowTransplantResearchand theAmericanSociety forBloodandMarrowTransplantation (EBMT/CIBMTR/ASBMT).BoneMarrowTransplant2006;37:249-261.
11. FaraciM,BékássyAN,DeFazioV,TichelliA,DiniG;EBMTPaediatricandLateEffectsWorkingParties.Non-endocrinelatecomplicationsinchildrenafterallogeneichaematopoieticSCT.BoneMarrowTransplant2008;41:S49-S57.
12. LocatelliF.,ZeccaM.,RondelliR.,BonettiF.,DiniG.,PreteA.,etal.GraftversusHostDiseaseprophylaxiswithlowdosecyclosporine-AreducestheriskofrelapseinchildrenwithacuteleukemiagivenHLAidenticalsiblingbonemarrowtransplantation:resultsofarandomizedtrial.Blood2000;951572-1579.
13. MessinaC.,FaraciM.,deFazioV.,DiniG.,CaloMP.,CaloreE.,etal.PreventionandtreatmentofacuteGvHD.BoneMarrowTransplant2008;41:S65-S70.
14. Bacigalupo A. Antilymphocyte/thymocyte globulin for graft versus host disease prophylaxis: efficacy and sideeffects.BoneMarrowTransplan2005;35:225-231.
15. Slavin S., Nagler A., Naparstek E., KapelushnikY., Aker M., Cividalli G., et al. Non-myeloablative stem celltransplantationwithletalcytoreductionforthetreatmentofmalignantandnonmalignanthematologicdiseases.Blood1998;91:756-63.
ComplicacionesagudasenelTrasplantedeProgenitoresHematopoyéticos1. Miano M., Faraci M., Dini G., Bordigoni P.; EBMT Paediatric Working Party. Early complications following
haematopoieticSCTinchildren.BoneMarrowTransplant2008:41;S39–S42.

620
Guías ClínicasSociedad Chilena de Trasplante
2. BensingerW., Schubert M., Ang KK., Brizel D., Brown E., Eilers JG., et al. Prevention and management ofmucositisincancercare.JNatlComprCancNetw2008:6:Suppl1:S1-S21.
3. WilliamsonA.,HoggartB.Pain:areviewofthreecommonlyusedpainratingscales.JClinNurs2005;14:798-804.
4. LallaR.,SonisS.,PetersonD.,ManagementofOralMucositisinPatientswhohadCancer.DentClinNorthAm2008;52:61–77.
5. MurraySM.,PindoriaS.Nutritionsupport forbonemarrow transplantpatients.CochraneDatabaseSystRev.2009:21;(1):CD002920.
6. Nicolatou-GalitisO.,VelegrakiA.,Sotiropoulou-LontouA.,DardoufasK.,KoulouliasV.,KyprianouK.,etal.Effectoffluconazoleantifungalprophylaxisonoralmucositisinheadandneckcancerpatientsreceivingradiotherapy.SupportCareCancer200614:44–51.
7. Aframian DJ, Lalla RV, Peterson DE. Management of dental patients taking common hemostasisalteringmedications.OralSurgOralMedOralPatholOralRadiolEndod2007103:S45.e1–11.
8. FedericiAB.,SaccoR.,StabileF.,CarpenedoM.,ZingaroE.,MannucciPM.OptimisinglocaltherapyduringoralsurgeryinpatientswithvonWillebranddisaese:effectiveresultsfromaretrospectiveanalysisof63cases.Haemophilia2000:6:71-7.
9. AisaY.,MoriT.,KudoM.,YashimaT.,KondoS.,YokoyamaA.,etal.Oralcryotherapyforthepreventionofhigh-dosemelphalan-inducedstomatitisinallogeneichematopoieticstemcelltransplantrecipients.SupportCareCancer200513:266–269.
10. CascinuS.,FedeliA.,FedeliSL.,CatalanoG.Oralcooling(cryotherapy),aneffectivetreatmentforthepreventionof5-fluorouracil-inducedstomatitis.EurJCancerBOralOncol199430B:234–236.
11. KeefeDM.,SchubertMM.,EltingLS.,SonisST.,EpsteinJB.,Raber-DurlacherJE.,etal.UpdatedClinicalPracticeGuidelinesforthePreventionandTreatmentofMucositis.Cancer2007;109:820–831.
12. Sauer-Heilborn A., Kadidlo D., McCullough J. Patient care during infusion of hematopoietic progenitor cells.Transfusion2004;44:907-916.
13. GravesV,DanielsonC,AbonourR,etal.Howtoensuresafeandwell-toleratedstemcellinfusions.Transfusion1998;38(Suppl):30S.
14. StylerMJ.,TopolskyDL.,CrilleyPA.,CovaleskyV.,BryanR.,BulovaS.,etal.Transienthighgradeheartblockfollowingautologousbonemarrowinfusion.BoneMarrowTransplant1992;10:435-438.
15. KeungYK.,LauS.,ElkayamU.,ChenSC.,DouerD.Cardiacarrhythmiaafterinfusionofcryopreservedstemcells.BoneMarrowTransplant1994;14:363-367.
16. LibermanD.,TeachSJ.ManagementofAnaphylaxisinChildren.PediatrEmergCare2008;24:861-866.
17. SheikhA.,ShehataYA.,BrownSG.,SimonsFE.Adrenalineforthetreatmentofanaphylaxis:cochranesystematicreview.Allergy2009;64:204–212
18. MuraroA.,RobertsG.,ClarkA.,EigenmannPA.,HalkenS.,LackG.,etal.Themanagementofanaphylaxisinchildhood:positionpaperoftheEuropeanacademyofallergologyandclinicalimmunology.Allergy2007:62:857-871.
19. JonesRJ.,LeeKS.,BeschornerWE.,VogelVG.,GrochowLB.,BraineHG.,etal.Veno-occlusivediseaseoftheliverfollowingbonemarrowtransplantation.Transplantation1987;44:778–783.
20. Senzolo M., Germani G., Cholongitas E., Burra P., Burroughs AK., et al.Veno occlusive disease: Update onclinicalmanagement.WorldJGastroenterol2007;13:3918-3924.
21. HelmyA.Reviewarticle:updatesinthepathogenesisandtherapyofhepaticsinusoidalobstructionsyndrome.AlimentPharmacolTher2006;23:11–25.
22. QureshiA,MarshallL,LancasterD.Defibrotide in thepreventionand treatmentof veno-occlusivedisease inautologousandallogeneicstemcelltransplantationinchildren.PediatrBloodCancer2008;50:831-832.
23. ChopraR.,EatonJD.,GrassiA.,PotterM.,ShawB.,SalatC.,NeumeisterP.,etal.,Defibrotideforthetreatmentofhepaticveno-occlusivedisease:resultsoftheEuropeancompassionate-usestudy.BrJHaematol2000;111:1122-1129.
24. BoyerTD,HaskalZJ.;AmericanAssociationforthestudyofLiverDiseases.Theroleoftransjugularintrahepaticportosystemicshuntinthemanagementofportalhypertension.Hepatology2005;41:386-400.
25. RuutuT.,BarosiG.,BenjaminRJ.,ClarkRE.,GeorgeJN.,GratwohlA.,etal.Diagnosticcriteriaforhematopoieticstemcelltransplant-associatedmicroangiopathy:resultsofaconsensusprocessbyanInternationalWorkingGroup.Haematologica2007;92:95–100.

621
Trasplante de progenitoreshematopoyéticos en pediatría
26. BattsED.,LazarusHM.Diagnosisandtreatmentoftransplantation-associatedthromboticmicroangiopathy:realprogressorarewestillwaiting?.BoneMarrowTransplant2007;40:709–719.
27. DalyAS.,XenocostasA.,LiptonJH.Transplantationassociatedthromboticmicroangiopathy: twenty-twoyearslater.BoneMarrowTransplant2002;30:709–715.
28. DuaA.,ZeiglerZR.,ShadduckRK.,NathR.,AndrewsDF.3rd.,AghaM.,etal.Apheresisingrade4bonemarrowtransplantassociatedthromboticmicroangiopathy:acaseseries.JClinApheresis1996;11:176–184.
29. WolffD.,WilhelmS.,HahnJ.,GentiliniC.,HilgendorfI.,SteinerB.,etal.Replacementofcalcineurininhibitorswithdaclizumabinpatientswithtransplantation-associatedmicroangiopathyorrenalinsufficiencyassociatedwithgraft-versushostdisease.BoneMarrowTransplant2006;38:445–451.
30. CortiP.,UderzoC.,TagliabueA.,DellaVolpeA.,AnnaloroC.,TagliaferriE.,etal.,Defibrotideasapromisingtreatment for thrombotic thrombocytopenic purpura in patients undergoing bone marrow transplantation.BoneMarrowTransplant2002;29:542–543.
31. AuWY.,MaES.,LeeTL.,HaSY.,FungAT.,LieAK.,etal.Successfultreatmentofthromboticmicroangiopathyafterhaematopoieticstemcelltransplantationwithrituximab.BrJHaematol2007;137:475–478.
32. TakatsukaH.,TakemotoY.,IwataN.,SuehiroA.,HamanoT.,OkamotoT.,etal.Oraleicosapentaenoicacidforcomplicationsofbonemarrowtransplantation.BoneMarrowTransplant2001;28:769–774.
33. KajiumeT.,NagitaA.,YoshimiS.,KobayashiK.,KataokaN.,etal.Acaseofhemolytic-uremicsyndromeimprovedwithnitricoxide.BoneMarrowTransplant2000;25:109–110
34. Gorczynska E.,Turkiewicz D., Rybka K.,Toporski J., Kalwak K., Dyla A., et al. Incidence, clinical outcome, andmanagementofvirus-inducedhemorrhagiccystitisinchildrenandadolescentsafterallogeneichematopoieticcelltransplantation.BiolBloodMarrowTransplant2005;11:797–804.
35. DeckerDB.,KaramJA.,WilcoxDT.Pediatrichemorrhagiccystitis.JPediatrUrol2009;5:254-264.
36. GiraudG.,BogdanovicG.,PriftakisP.,RembergerM.,SvahnBM.,BarkholtL.etal.TheincidenceofhemorrhagiccystitisandBKviruriainallogeneichematopoieticstemcellrecipientsaccordingtointensityoftheconditioningregimen.Hematologica2006;91:401-404.
37. StyczynskiJ.,GilL.;EBMTPaediatricDiseasesWorkingParty.PreventionofinfectiouscomplicationsinpediatricHSCT.BoneMarrowTransplant2008;42:S77–S81.
38. CastagnolaE.,FaraciM.,MoroniC.,BandettiniR.,CarusoS.,BagnascoF.,etal.BacteremiasinchildrenreceivinghemopoieticSCT.BoneMarrowTransplant2008;41:S104–6.
39. FeuchtingerT.,LangP.HandgretingerR.Adenovirus infectionafterallogeneicstemcell transplantation.LeukLymphoma2007;48:244–255.
40. CDC, Infectious Disease Society of America, and the American Society of Blood and MarrowTransplantation.Guidelines for Preventing Opportunistic Infections Among Hematopoietic Stem Cell Transplant RecipientsRecommendationsofCDC,theInfectiousDiseaseSocietyofAmericaandtheAmericanSocietyofBloodandMarrowTransplantation.Cytotherapy2001;3:41-54.
41. SantolayaME.,RabagliatiR.,BidartT.,PayáE.,GuzmánAM.,MoralesR.,etal.,Consenso:Manejoracionaldelpacienteconcáncer,neutropeniayfiebre.RevChilInfect2005;22:S79-S113.
42. LjungmanP.,delaCamaraR.,CordonnierC.,EinseleH.,EngelhardD.,ReusserP.,etal.ManagementofCMV,HHV-6,HHV-7andKaposi-sarcomaherpesvirus(HHV-8)infectionsinpatientswithhematologicalmalignanciesandafterSCT.BoneMarrowTransplant2008;42:227-240.
43. CohenJ.,GandhiM.,NaikP.,CubittD.,RaoK.,ThakerU.,etal Increase incidenceofEBV- relateddiseasefollowingpaediatric stemcell transplantationwith reduced-intensity conditioning.Br JHaematology2009;129:229–239.
44. GreenfieldHM.,GharibMI.,TurnerAJ.,GuiverM.,CarrT.,WillAM.,etal.TheImpactofmonitoringEpstein-BarrVirus PCR in paediatric bone marrow transplant patients: Can it successfully predict outcome and guideintervention?PediatrBloodCancer2006;47:200-205.
45. KinchA.,ObergG.,ArvidsonJ.,FalkKI.,LindeA.,PauksensK.,etal.Post-transplantlymphoproliferativediseaseandotherEpstein-Barrvirusdiseasesinallogeneichaematopoieticstemcelltransplantationafterintroductionofmonitoringofviralloadbypolymerasechainreaction,ScandJInfectDis2007;39:235-244.
46. FreyNV.,TsaiDE.,TheManagementofPosttransplantLymphoproliferativeDisorder.MedOncol2007;24:125-136.
47. TrastornoLinfoproliferativoPostTrasplante(TLPT).PalmaJ.,SotomayorC.,En:TratadodeOncologíaPediátrica,Ed.:SierrasesúmagaL.,AntillónF.,BernaolaE.,PatiñoA.,SanJuliánM.,1eraedición.PearsonEducaciónS.A.,Madrid,España,2006,p.353-363.

622
Guías ClínicasSociedad Chilena de Trasplante
48. AsciogluS.,RexJH.,dePauwB.,BennettJE.,BilleJ.,CrokaertF.,etal.DefiningOpportunisticInvasiveFungalInfections in Immunocompromised Patients with Cancer and Hematopoietic Stem Cell Transplants: AnInternationalConsensus.ClinInfectDis2002;34:7–14.
49. WalshTJ.,AnaissieEJ.,DenningDW.,HerbrechtR.,KontoyiannisDP.,MarrKA.,etal.TreatmentofAspergillosis:ClinicalPracticeGuidelinesoftheInfectiousDiseasesSocietyofAmerica.ClinInfectDis2008;46:327–360.
50. DerouinF.,PellouxH.;ESCMIDStudyGrouponClinicalParasitology.Preventionoftoxoplasmosisintransplantpatients.ClinMicrobiolInfect2008;14:1089-1101.
51. RihnC.,CilleyJ.,NaikP.,PedicanoAV.,MehtaJ.Definitionofmyeloidengraftmentafterallogeneichematopoieticstemcelltransplantation.Haematologica2004;88:763-764.
52. Wolff SN. Mini-review Second hematopoietic stem cell transplantation for the treatment of graft failure, graftrejectionorrelapseafterallogeneictransplantation.BoneMarrowTransplant2002;29:545–552.
53. SpitzerTR.,EngraftmentsyndromefollowinghematopoieticstemcelltransplantationBoneMarrowTransplantation2001;27:893–898.
SeguimientopostTPHycomplicacionescrónicas1. RizzoJD.,WingardJR.,TichelliA.,LeeSJ.,VanLintMT.,BurnsLJ.,etal.Recommendedscreeningandpreventive
practices for long-term survivors after haematopoietic cell transplantation: joint recommendations of theEuropeanGroupforBloodandMarrowTransplantation,CentreforInternationalBloodandMarrowTransplantResearchand theAmericanSociety forBloodandMarrowTransplantation (EBMT/CIBMTR/ASBMT).BoneMarrowTransplant2006;37:249-261.
2. FaraciM.,BékássyAN.,DeFazioV.,TichelliA.,DiniG.;EBMTPaediatricandLateEffectsWorkingParties.Non-endocrinelatecomplicationsinchildrenafterallogeneichaematopoieticSCT.BoneMarrowTransplant2008;41:S49-S57.
3. DahllofG.,BarrM.,BolmeP.,ModéerT.,LonqvistB.,RingdenO.,etal.DisturbanceindentaldevelopmentafterTBIinbonemarrowrecipients.OralSurgOralMedOralPathol1988;65:41-44.
4. UderzoC.,PillonM.,CortiP.,TridelloG.,TanaF.,ZintlF.,etal.Impactofcumulativeanthracyclinedose,preparativeregimenandchronicgraftversushostdiseaseonpulmonaryandcardiacfunctioninchildren5yearsafterallogeneichematopoieticstemcelltransplantation:aprospectiveevaluationonbehalfoftheEBMTPediatricDiseasesandLateeffectsWorkingParties.BoneMarrowTransplant2007;39:667-675.
5. SoubaniAO.,UbertiJP.Bronchiolitisobliteransfollowinghaematopoieticstemcelltransplantation.EurRespirJ2007;29:1007-1019.
6. DahllofG.,HingoraniSR.,SandersJE.Lateeffectsfollowinghematopoieticcelltransplantationforchildren.BiolBloodMarrowTransplant2008;14:88-93.
7. TichelliA.,RovóA.,GratwohlA.Latepulmonary,cardiovascularandrenalcomplicationsafterhematopoieticstemcell transplantation and recommended screening practices. Hematology Am Soc Hematol Educ Program2008:125-133.
8. CohenA.,BékássyAN.,GaieroA.,FaraciM.,ZeccaS.,TichelliA.,etal.EndocrinologicallatecomplicationsafterhematopoieticSCTinchildren.BoneMarrowTransplant2008;41:S43-S48.
9. SociéG,SelimiF,SedelL,FrijaJ,DevergieA,EspperouBourdeauH.,etal.Avascularnecrosisofboneafterallogeneicbonemarrowtransplantation:clinicalfindings,incidenceandriskfactors.BrJHaematol1994;86:624-628.
10. BakerSK.,DeforTE.,BurnsL.,RamsayNK.,NegliaJP.,RobinsonLL.Newmalignanciesafterbloodormarrowstemcelltransplantationinchildrenandadults:incidenceandriskfactors.JClinOncol2003;21:1352-1358.
11. FelderOuigR.,DiGalloA.,WaldenmairM.,NordenP.,WinterA.,GadnerH.,etal.Healthrelatedqualityoflifeinpediatricpatientsreceivingallogeneicstemcellorbonemarrowtransplantation:resultsofalongitudinal,multi-centrestudy.BoneMarrowTransplant2006;38:119-126.
InmunoreconstituciónpostTrasplantedeProgenitoresHematopoyéticos1. ImamuraM.Immunologicalreconstitutionandimmunoregulatorycellsinhematopoieticstemcelltransplantation.
IntJHematol2002;76:191-194.
2. GressRE.,KomanduriKV.,EinseleH.,CooperLJ.Lymphoidreconstructionandvaccines.BiolBloodMarrowTransplant2007;13:17-22.
3. MarinGH.,MendezMC.,MennaME.,MalacalzaJ.,BergnaMI.,KleinG.,etal.. Immunerecoveryafterbonemarrowandperipheralbloodstemcellstransplantation.TransplantProc1999;31:2582-2584.

623
Trasplante de progenitoreshematopoyéticos en pediatría
4. TriggME.Post-transplant immune recoveryand the implication for infection risk. IntJHematol2002;76:199-205.
VacunasenelpacientesometidoaTrasplantedeProgenitoresHematopoyéticos1. LjungmanP.,EngelhardD.,delaCámaraR.,EinseleH.,LocasciulliA.,MartinoR.,etal.Vaccinationofstemcell
transplantrecipients:recommendationsoftheInfectiousDiseasesWorkingPartyoftheEBMT.BoneMarrowTransplant2005;35:737–746.
2. CDC,InfectiousDiseaseSocietyofAmerica,andtheAmericanSocietyofBloodandMarrowTransplantation.Guidelines for preventing opportunistic infections among hematopoietic stem cell transplant recipients.RecommendationsofCDC,theInfectiousDiseaseSocietyofAmerica,andtheAmericanSocietyofBloodandMarrowTransplantation.Cytotherapy2001;3:41-54.
3. AppelbaumF.,FormanS.,NegrinR.,BlumeK.En:Thoma’sHematopoieticCellTransplantation.FourthEdition.Wiley- Blackwell UK, (2009). Chapter 108.Vaccination of allogeneic and autologous hematopoietic cellrecipients.Small,Trudy:1664-1670.
4. Policy #IX-Q.02. “Immune Reconstitution Testing”. Policies, Procedures and Clinical Guidelines Manual. TheChildren’sMemorialHospitalStemCellTransplantProgram,Chicago,IL60614.7–5–2005.(fecharevision6-4–2008).
5. Policy #IX-R.02. “Re-inmunization Guidelines”. Policies, Procedures and Clinical Guidelines Manual. TheChildren’sMemorialHospitalStemCellTransplantProgram,Chicago,IL60614.7–5–2005.(fecharevision6-4-2008).
Acreditación1. LeMaistreCF.,LoberizaFR.Jr.Whatisqualityinatransplantprogram?BiolBloodMarrowTransplant.2005;11:
241-246.
2. TheHistoryofFACT[enlínea]http://www.factwebsite.org/main.aspx?id=31[consultadoel15deabril2009].
3. CTP Facility Search Results [en línea] http://www.factwebsite.org/FacilitySearchResults.aspx?Type=FACT[consultadoel15deabril2009].
4. Accredited Facilities [en línea] http://www.jacie.org/portal/jacie/facilities/Controller;jsessionid=BE33D30657E53AFDF901C0653B5BDE8F?mvchandler=portals&action=show-screen&screen=workspace&idSection=1345[consultadoel18deJunio2009].
5. Ley19.937.Chile.ModificaelD.L.Nº2.763de1979,conlafinalidaddeestablecerunanuevaconcepcióndelaautoridadsanitaria,distintasmodalidadesdegestiónyfortalecer laparticipaciónciudadana.MinisteriodeSalud,DiarioOficial,Chile,Febrero2004.
6. PalmaJ.,MossoC.,ParisC.,CampbellM.,TongX.,KingA.,etal.EstablishmentofapediatricHSCTprograminapublichospitalinChile.PediatrBloodCancer2006;46:803-810.
7. Matthes-MartinS.,PötschgerU.,BergmannK.,FrommletF.,BrannathW.,BauerP.,etal.Risk-AdjustedOutcomeMeasurementinPediatricAllogeneicStemCellTransplantation.BiolBloodMarrowTransplant.2008;14:335-343.







![FFPC 6th edition update (1) · í W í X í X î í ì í W í X í X íd ] o X í W í X í X îd ] o Xd Z ] o } ( Z ] } Z o o E&W í U& ] í W í X ï X î X ñd Z & o } ] µ ]](https://static.fdocuments.in/doc/165x107/5e76e4298c675673fd5c957e/ffpc-6th-edition-update-1-w-x-x-w-x-x-d-o-x-.jpg)


![} v } u ] Z À ] } ( } ] Ç · 2018. 11. 28. · s Z ' î ì í í î ì í î î ì í ï î ì í ð î ì í ñ î ì í ò z î ì í í î ì í î î ì í ï î ì í ð î](https://static.fdocuments.in/doc/165x107/601e1b37d8b1f16a0800f14a/-v-u-z-2018-11-28-s-z-.jpg)