Apostila Parasitologia
description
Transcript of Apostila Parasitologia

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 1
Manual de Técnicas Parasitológicas
FASI
Estágio Supervisionado
Professor : Rafael Ramos Lages Bento Aluno: _____________________

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 2
SUMÁRIO 1 - Glossário de parasitologia 2 - Introdução a parasitologia clínica 3 - Relações entre os seres vivos 4 - Classificação dos parasitas 5 - Exame parasitológico das fezes 6 - Exame parasitológico do sangue 7 - Exame parasitológico das secreções 8 - Breve resumo das parasitoses mais comuns no Brasil 9 - Pesquisa de sangue oculto nas fezes 10 - Bibliografia

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 3
1- Glossário de Parasitologia (Fonte: Neves et al., 2000) AGENTE ETIOLÓGICO – É o agente causador ou responsável pela origem da doença. AGENTE INFECCIOSO – Parasito capaz de produzir infecção ou doença infecciosa. CEPA – Grupo ou linhagem de um agente infeccioso, de ascendência conhecida, compreendida dentro de uma espécie e que se caracteriza por alguma propriedade biológica e/ou fisiológica. ENDEMIA – É a prevalência usual de uma doença com relação à área. Considera-se como endêmica a doença cuja incidência permanece constante por vários anos, dando uma idéia de equilíbrio entre a doença e a população, ou seja, é o número esperado de casos de um evento em determinada época. EPIDEMIA – É a ocorrência de casos que ultrapassam nitidamente a incidência normalmente esperada de uma doença e derivada de uma forte comum de infecção ou propagação. ESTÁDIO – É a fase intermediária ou intervalo entre duas mudas de larva de um artrópode ou helminto. ESTÁGIO – É a fase ou forma evolutiva de um organismo durante seu ciclo biológico. FASE AGUDA – É o período após a infecção em que os sintomas clínicos são mais marcantes. É um período de definição: o individuo se cura entra na fase crônica ou morre. FASE CRÔNICA – É aquela que se segue à fase aguda; caracteriza-se pela diminuição da sintomatologia clínica e existe um equilíbrio relativo entre o hospedeiro e o agente infeccioso. HOSPEDEIRO – É um organismo que alberga o parasito. HOSPEDEIRO DEFINITIVO – É o que apresenta o parasito em fase de maturidade ou em fase de atividade sexual. HOSPEDEIRO INTERMEDIÁRIO – É aquele que apresenta o parasito em fase larvária ou assexuada. HOSPEDEIRO PARATÊNICO – É o hospedeiro intermediário no qual o parasito não sofre desenvolvimento, mas permanece encistado até que o hospedeiro definitivo o ingira. INCIDÊNCIA – É a frequência com que uma doença ou fato ocorre num período de tempo definido e com relação à população. INFESTAÇÃO – É o alojamento, desenvolvimento e reprodução de artrópodes na superfície do corpo ou vestes. MORBIDADE – Expressa o número de pessoas doentes com relação a população. MORTALIDADE – Determina o número geral de óbitos em determinado período de tempo e com relação à população. PARASITEMIA – Reflete a carga parasitária no sangue do hospedeiro.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 4
PARASITO ACIDENTAL – É o que parasita outro hospedeiro que não o seu normal. PARASITA ERRÁTICO – É o que vive fora do seu habitat normal. PARTENOGÊNESE – Desenvolvimento de um ovo sem interferência de um espermatozóide. PATOGENIA – É o mecanismo com que um agente infeccioso provoca lesões no seu hospedeiro. PERÍODO DE INCUBAÇÃO – É o período decorrente entre o tempo de infecção e o aparecimento dos primeiros sintomas clínicos. PERÍODO PRÉ-PATENTE – É o período que decorre entre a infecção e o aparecimento das primeiras formas detectáveis do agente infeccioso. RESERVATÓRIO – Onde vive e se multiplica um agente infeccioso. VETOR – É um artrópode, molusco ou veículo que transmite o parasito entre dois hospedeiros. ZOONOSE – Doença e infecções que são naturalmente transmitidas entre animais vertebrados e o homem. 2- INTRODUÇÃO À PARASITOLOGIA CLÍNICA Este curso de Parasitologia clínica tem como objetivo propiciar um embasamento teórico que permite ao aluno uma visão completa das doenças parasitárias, a fim de ser capaz de compreender, refletir, discutir e principalmente diagnosticar as parasitoses humanas. Alguns pontos importantes de parasitologia serão considerados a seguir: 2.1. Parasitismo Parasitismo é a interação ecológica entre indivíduos de espécies diferentes, em que os parceiros (hospedeiros e parasito) estabelecem entre si relações íntimas e duradouras com certo grau de dependência metabólica. Geralmente o hospedeiro proporciona ao parasito todos os nutrientes e as condições fisiológicas requeridas por este. É importante salientar que um processo de adaptação recíproco, de compatibilidade ou de baixa virulência do parasitismo, assegura a sobrevivência de ambas às espécies. O parasito só poderá seguir existindo se não destruir toda a população de seus hospedeiros ou não impedir a reprodução destes; caso contrário à espécie parasitária desapareceria. 2.2. Especificidade de hospedeiros Segundo as necessidades particulares de cada parasito (sejam elas de ordem metabólica ou de outra natureza), ele exigirá apenas determinada espécie de hospedeiros ou um grupo de diferentes espécies ou, ainda, grande variedade e gêneros distintos. Se o parasito exigir apenas uma espécie de hospedeiros para completar seu ciclo biológico, será dito monoxeno e, se a espécie for sempre a mesma, será considerado estenoxeno, como o Ascaris lumbricoides que só parasita a espécie humana. Ao contrário, parasitos heteroxenos são aqueles que necessitam passar obrigatoriamente por dois ou mais hospedeiros. Um deles é o hospedeiro definitivo e os demais são considerados hospedeiros

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 5
intermediários, para que os parasitos possam completar seu ciclo biológico. Assim, a tênia do porco (Taenia solium), só parasita o homem na fase adulta. 2.3. Tipos de adaptações ao parasitismo A adaptação é a marca do parasitismo. Elas evoluíram de forma a proporcionar um melhor relacionamento do parasito com seu hospedeiro. E esta evolução feita à custa de adaptações tomou o invasor (parasito) mais e mais dependente do outro ser vivo (hospedeiro). As adaptações são principalmente morfológicas, fisiológicas e biológicas. As principais modificações ou adaptações são as seguintes: a) Morfológicas:
- Degenerações: representadas por perdas ou atrofias de órgãos locomotores, aparelho digestivo etc.
- Hipertrofia: encontradas principalmente nos órgãos de fixação, resistência ou proteção e reprodução.
b) Biológicas:
- Capacidade reprodutiva: para suplantar as dificuldades de atingir novo hospedeiro e escaparem de predação externa, os parasitos são capazes de produzir grandes quantidades de ovos, cistos, ou outras formas infectantes.
- Tipos diversos de reprodução: outros tipos de reprodução permitem uma reprodução mais fácil ou mais segura como, por exemplo, hermafroditismo, partenogênese, poliembrionia, esquizogonia.
- Capacidade de resistência à agressão do hospedeiro: presença d enzimas que neutralizam a ação dos sucos digestivos; capacidade de resistir à ação de anticorpos; capacidade de induzir imunossupressão e etc.
- Tropismos: os diversos tipos de tropismos são capazes de facilitar a propagação, reprodução ou sobrevivência de determinada espécie de parasito.
2.4. Relações parasito-hospedeiro: Os parasitos que causam distúrbios no organismo podem faze-lo mecanicamente, ao crescerem e comprimirem as estruturas em torno. Ou obstruir ductos, canais ou vasos, causando sintomatologias a mais variadas, que serão analisadas adiante em cada caso. Podem exercer ação tóxica, devido aos produtos de seu metabolismo ou de algum simbionte associado ao parasito. Mas, com freqüência, provocam uma resposta do sistema imunológico com diferentes resultados:
a) Destruição do próprio parasito e cura da infecção dentro de certo prazo; b) Limitação da população parasitária, assegurando equilíbrio nas relações parasito-hospedeiro; c) Causando respostas alérgicas ou inflamatórias que levam seja à necrose do tecido em torno,
seja a uma fibrose difusa ou à formação de granulomas. Todos estes fenômenos alteram a fisiologia do hospedeiro em grau maior (doença) ou menor ou determinam sua morte em curto ou longo prazo. 3- RELAÇÕES ENTRE OS SERES VIVOS Para obter melhores abrigos e alimentos, muitas espécies convivem em um mesmo ambiente, gerando associações ou interações que podem não interferir entre si. Essas associações podem ser harmônicas (quando há beneficio mútuo ou ausência de prejuízo mútuo) ou desarmônicas (quando há prejuízo para algum dos participantes). Em seguida conceituaremos os tipos de associações mais frequentes:

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 6
a) Associações harmônicas
- Comensalismo: É uma associação onde uma obtém vantagens sem prejuízo para outro. Essas vantagens podem ser: proteção (habitação), transporte (meios de locomoção) e nutrição. Exemplo: Entamoeba coli no intestino grosso do homem.
- Mutualismo: É quando duas espécies se associam para viver e ambas são beneficiadas. É uma associação obrigatória. Exemplo: protozoários Hypermastiginia no intestino de cupins.
- Simbiose: Associação onde há uma troca de vantagens em nível tal que esses seres são incapazes de viver isoladamente. Nessa associação, as espécies realizam funções complementares, indispensáveis à vida de cada uma. Exemplo: diversas espécies de protozoários que vivem no rúmen de bovinos que proporcionam a digestão da celulose ingerida.
b) Associações desarmônicas
- Competição: Pode ocorrer entre elementos de uma mesma espécie ou de espécies distintas. É um importante fator de regulação do nível ou número populacional de certas espécies.
- Canibalismo: É o ato de um animal se alimentar de outro da mesma espécie ou da mesma família. Ocorre quase sempre devido à superpopulação e deficiência alimentar.
- Predatismo: É quando uma espécie animal se alimenta de outra espécie. Ou seja, a sobrevivência de uma depende da morte da outra.
4- CLASSIFICAÇÃO DOS PARASITOS Entre os animais que parasitam o homem, e estarão sendo estudados neste curso, estão incluídos três grandes filos: Protozoa (animais unicelulares: protozoários), Platyhelminthes (vermes achatados), Aschelminthes (vermes redondos) .
a) Protozoa - Sub filo Sarcomastigophora - Ordem: Kinetoplastida - Gênero: Trypanosoma
Leishamania - Ordem: Diplomonadida
- Gênero: Giardia - Ordem: Amoebida
- Gênero: Entamoeba - Ordem: Trichomonadida - Gênero: Trichomonas
- Sub filo Apicomplexa - Ordem: Eucoccidiida - Gênero: Isospora
Toxoplasma Plasmodium

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 7
b) Platyhelminthes - Classe: Cestoda
- Gênero: Taenia Hymenolepis
- Classe: Trematoda
- Gênero: Schistosoma
c) Aschelminthes - Classe: Nematoda - Gênero: Ascaris Enterobius
5- EXAME PARASITOLÓGICO DAS FEZES 5.1- Introdução: O exame parasitológico das fezes representa a providência de fundamental importância para o diagnóstico das parasitoses intestinais e da Esquistossomose Mansônica. Sua execução envolve a utilização de vários métodos que objetivam a pesquisa de Protozoários Intestinais na sua forma císticas e vegetativas como também de Helmintos na sua forma adulta, seus ovos e suas larvas. 5.2- Importância: 1º) Na clínica. 2º) No controle de tratamento e da cura. 3º) Nos inquéritos epidemológicos. 5.3- Considerações gerais: 1) Identificação das formas evolutivas dos parasitas: - (geralmente é fácil, suas dimensões, contornos e suas características estruturais não deixam duvidas). 2) Numero de métodos utilizados na análise: - (Não há até o momento um método que tenha características de onivalência e, portanto impõe-se que se utilize um conjunto de métodos para a determinação do espectro parasitário do paciente). 3) Grau de infecção e ou infestação: - (A intensidade do parasitismo, influi o número de formas parasitarias eliminadas). 4) Particularidades biológicas dos parasitas: - (Alguns parasitas em face da sua biologia, não são detectados pêlos métodos coprológicos convencionais, necessitando-se empregar métodos especiais). 5) Períodos negativos de eliminação: a) Há períodos negativos onde o parasitismo não pode ser demonstrado. b) A regularidade da eliminação esta na dependência de vários fatores dentre eles a dieta (amebídeos). c) Para o diagnostico e o controle de tratamento se impõe uma serie de exames consecutivos realizados num período de 8 a 10 dias.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 8
5.4- Precauções : Além da possível presença de formas infectantes ou infestantes de enteroparasitos, há a possibilidade de que o material contenha bactérias e vírus patogênicos, portanto deve-se manuseá-lo com cuidado e sempre com material de proteção. 5.5- Causas de erros : Podem ocorrer tanto no processamento do material quanto na identificação do parasito. 1-) Modificações intempestivas nos métodos. 2-) Inexperiência em identificação microscópica. 3-) Examinar preparações não coradas. 4-) Utilização de água poluída contendo protozoários e nematódeos de vida livre nas técnicas. 5-) Falta de condições de trabalho. (material adequado, equipamentos, soluções, sais, espaço físico, etc.) 6-) Falta de conhecimento teórico em parasitologia. 7-) Falta de dedicação do laboratorista. 5.6- Resultados do exame: 1-) Qualitativo : Negativo ou Positivo para ovos ou cistos de ... 2-) Semi-Quantitativo: (+) ou Raríssimos ovos ou cistos de ... (++) ou Raros ovos ou cistos de... (+++) ou Alguns ovos ou cistos de... (++++) ou Freqüentes ovos ou cistos de... 3-) Quantitativo: Nº de ovos ou cistos por gramas de fezes. Obs: os métodos qualitativos são mais usados, pois a dose dos medicamentos antiparasitária não leva em conta a carga parasitária, e sim o peso corporal do paciente. 5.7- Colheita do material : É realizada pelo interessado no domicilio. A matéria fecal deve ser colhida em um vaso esmaltado ou outro recipiente, bem limpo e seco, e enviada ao laboratório no mesmo dia, caso não for usado conservadores. A amostra mais significativa na clínica, é uma coleta feita em 3 dias alternados, com o uso do conservador. Observação: Não misturar a matéria fecal com água, urina ou anticépticos. Frasco de colheita: Coletor universal ou um vidro de boca larga quimicamente limpo e seco. Volume da amostra: 20 a 30 gramas. Fezes Formadas ou Pastosas: Deve ser enviado ao laboratório o mais breve possível (Tolerância máxima de 12 horas em temperatura ambiente). Material Diarréico ou Disentérico: Não há tolerância, o material deve ser enviado ao laboratório o mais breve possível, de preferência com um conservador (Frio, Formol, MIF, etc.). 5.8- Conservadores para as Fezes: 1-) Frio : Coloca-se as fezes na geladeira ou em caixas contendo gelo e serragem. Em temperatura de 5 a 10 ºC não ocorre putrefação e as fezes podem ser examinadas por até 2 a 3 dias após a emissão. 2-) Formol 5% a 10% : Em um frasco de boca larga usar uma parte de fezes para três de formol a 5% e homogeneizar bem. (conserva por mais de um mês). 3-) MIF: Sigla de mertiolato (ou Mercúrio-cromo), Iodo e Formol.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 9
Água destilada......................................250 ml Sol. De Mercúrio-Cromo a 1.500..........250 ml Formol....................................................25 ml Glicerina...................................................5 ml Usar uma parte de fezes para três de MIF. Adicionar gotas de Lugol (Iodo + Iodeto de potássio) ao material sedimentado. 4-) SAF: Iniciais dos componentes. Acetato de Sódio....................................1,5 ml Ácido Acético..........................................2,9 ml Formol 40%............................................4,0 ml Água destilada......................................92,5 ml Usar uma parte de fezes para três de SAF.
5.9- EXECUÇÃO DOS EXAMES: 5.9.1- Exame Macroscópico: a) Consistência : Moldada (ou formada), Pastosa, Diarréica, (ou disentérica). b) Cor: Decorre da presença de pigmento biliar (Estercobilina ou hidrobilirrubina), sofrendo influencia do regime alimentar, normalmente tem a cor Castanha Parda. c) Presença de muco: São pequenas estrias, em estado puro indicando inflamação ou ligeira irritação; quando associada ao pus, sangue e células epiteliais indica processo inflamatório mais severo(colites). d) Presença de sangue: Geralmente proveniente das vias baixas do trato intestinal com processos hemorroidários, ulcerações do sigmóide, disenteria bacilar, amebiana e outras patologias mais severas. e) Presença de restos alimentares: Detritos vegetais, tecido conjuntivo, fibras musculares, tecido adiposo e conectivo, gordura e etc. f) Outros elementos: Ovos ou espécies de Acarinos, larvas de miíases, (corpos estranhos como goma de mascar, botões) e etc. g) Parasitas Macroscópicos: Vermes adultos de Enterobius vermicularis e Ascaris lumbricoides, proglotes ou escólex de Taenia e etc. OBSERVAÇÃO: Para melhorar a eficiência da pesquisa de parasitas macroscópicos deve-se fazer a Tamização. 5.9.1.1- MÉTODO DA TAMIZAÇÃO: Lavagem e coagem das fezes em jato d’água em um tamis. 1- Dissolver as fezes em água de torneira; 2- Coar o material diluído em um tamis; 3- Dar jato d’água em uma torneira; 4- Observar macroscopicamente as estruturas.
Composição normal das fezes: Agua – 75% Bactérias mortas.....................................................30% Gordura............................................................10 a 20% Matéria sólida – 25% Matéria Inorgânica...........................................10 a 20% Proteínas.............................................................2 a 3% Restos não digeridos (cels. E pigmentos)...............30%

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 10
5.9.2- Exames Microscópicos: 5.9.2.1- MÉTODO DIRETO À FRESCO Utilizado para pesquisa de trofozoitos de protozoários em fezes frescas diarréicas ou disentéricas. Método de baixa sensibilidade, pois não utiliza um processo para concentração das formas parasitárias, somente é detectada quando presente em grande quantidade. 1.Transferir uma porção das fezes para uma lâmina de microscopia; 2. Pingar uma gota de Salina 0,85% ; 3.Espalhar as fezes na lâmina , colocar lamínula e observar ao microscópio em 10x e 40x.
5.9.2.2- MÉTODO DE HOFFMAN, PONS & JANER ou HPJ – ( Sedimentação espontânea) Utilizado na pesquisa de cistos de protozoários, ovos e larvas de helmintos, por sedimentação espontânea em água. 1. Dissolver cerca de 2g de fezes em 10 ml de H2O em um Copo de borrel (copo descartável); 2. Filtrar em peneira, utilizando um cálice de sedimentação; 4. Completar o cálice com água; 5. Deixar em repouso de 2 a 24 horas. Se o líquido estiver turvo, trocar somente o sobrenadante e repousar por mais 1 hora; 6. Com uma pipeta tampada, retirar uma amostra do fundo do vértice do cálice, destampando a pipeta após emergi-la; 7. Examinar ao microscópio em objetivas de 10x e 40x, adicionando uma gota da solução de lugol.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 11
5.9.2.3- MÉTODO DE WILLIS (Flutuação) Utilizado na pesquisa de ovos leves de helmintos, principalmente de Ancilostomídeos, por flutuação espontânea em solução de NaCl saturada. 1. Dissolver cerca de 10g de fezes em uma solução saturada de NaCl. (d:1,200) ; 2. Completar o frasco com a solução saturada de NaCl até formar um menisco convexo na boca do frasco ; 3. Colocar uma lâmina por sobre a borda do frasco para que fique em contato, aguardar por 5 min; 4. Retirar e inverter a lâmina sem escorrer o líquido e examinar ao microscópio em objetiva de 10x e 40 x.(uso de lamínula é facultativo).
5.9.2.4- MÉTODO DE RUGAI, BAERMANN-MORAES (Termohidrotropismo) (Utilizado na pesquisa de larvas de Nematódeos), pelo termohidrotropismo em água aquecida à 45º C, associado a ação da gravidade. 1. Aquecer água de torneira a 45º C, e colocar em um cálice de sedimentação; 2. Colocar as fezes em contato com esta água aquecida. (em peneira ou gaze dobrada em 4) 3. Aguardar sedimentar por 1 hora; 4. Colher o sedimento do fundo do cálice com ajuda de uma pipeta; 5. Colocar em uma lâmina, adicionar lugol e observar em microscópio em objetiva de 10x; Obs: Recomendável que as fezes seja colhida no dia do exame, pois a refrigeração diminui a viabilidade das larvas. Fezes diarréicas ou em conservador não se prestam para este método.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 12
5.9.2.5- MÉTODO DE FAUST – (Centrífugo-flutuação em Sulfato de Zinco) Utilizado na pesquisa de cistos e oocistos de protozoários e ovos leves de helmintos em solução de ZnSO4. Densidade: 1,180 1. Dissolver cerca de 10g de fezes em 20ml de água e homogeneizar bem; 2. Filtrar em peneira para um recipiente com bico; 3.Transferir o material em tubo cônico de centrífuga; 4.Centrifugar a 2500 rpm por 1 minuto; 5. Desprezar o sobrenadante e ressuspender o sedimento novamente em 10 ml de água; 6.Repetir os passos 4 e 5 até que o sobrenadante apresente-se claro; 7.Desprezar o sobrenadante e adicionar 10 ml de sulfato de zinco (ZnSO4) densidade 1,180; 8.Centrifugar novamente por 1 minuto a 2500 rpm ; 9.. Recolher com alça de platina a película superficial, colocar em uma lâmina e adicionar uma gota da solução de lugol , colocar lamínula e observar ao microscópio em 10x e 40x. Obs: material deve ser examinado rapidamente, pois o contato com o Sulfato de Zinco pode deformar as estruturas parasitárias.
5.9.2.6- MÉTODO DE GRAHAM – Swab Anal (Método da fi ta adesiva) Utilizado na pesquisa de ovos de Enterobius vermicularis. 1. Com auxílio de um tubo de ensaio como apoio, fazer pressão com uma fita gomada (durex) transparente com aparte colante sobre a região anal e perianal do paciente, de 3 a 4 vezes; 2. Colar a fita em uma lâmina e observar ao microscópio em 10x. OBS: Técnica deve ser feita ao amanhecer, antes do paciente ter feito higienização, e repetida em dias sucessivos caso dê negativo. Caso a lâmina não possa ser examinada no mesmo dia, embalar em papel alumínio e conservar em geladeira.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 13
5.9.2.7- MÉTODO DE KATO - KATZ (método quantitati vo) Utilizado principalmente na pesquisa e contagem de ovos de Schistosoma mansoni e outros helmintos. Utilização do Kit (quantitativo - OPG). Método de clarificação dos esfregaços de fezes. 1. Depositar uma pequena quantidade de fezes sobre uma folha de papel higiênico, comprimir as fezes com a tela(kit) por cima e pressionando com a paleta; 2. Colocar sobre uma lâmina de vidro a placa de plástico(kit) e depositar no centro do orifício as fezes que ultrapassaram as malhas da tela (40 - 60 mg); 3. Comprimir as fezes no orifício da placa até completá-lo; 4. Retirar a placa de plástico cuidadosamente; 5. Sobrepor a lamínula de celofane(kit) (embebida em verde malaquita) e inverter a lâmina sobre uma folha de papel absorvente e realizar pressão com o polegar sobre a lâmina até obter uma uniformidade do material; 6. Deixar em repouso por cerca de 1 a 2 horas a temperatura ambiente; 7. Contar todos os ovos encontrados e multiplicar o total por 23,resultando em ovos/grama de fezes;

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 14
5.9.2.8 – MÉTODO DO ÁCIDO ACÉTICO GLACIAL (IDENTIFI CAÇÃO DE PROGLOTES DE Taenia sp) 1. Colocar a proglote de Taenia em um recipiente contendo ácido acético glacial; 2. Aguardar 15 minutos; 3. Retira-la e comprimi-la entre duas lâminas de microscopia; 4.Examinar sobre iluminação intensa; 5. Os caracteres do útero e suas ramificações permitirão distinguir se a proglóte grávida é de Taenia solium ou Taenia saginata; Taenia solium : proglotes grávidas útero, ramificações laterais finas, dendríticas (arborosas) e pouco numerosas; Taenia saginata: proglotes grávidas com útero, ramificações espessas, dicotômicas e muito numerosas;
Taenia solium Taenia saginata

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 15
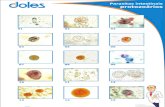
5.9.3- Estruturas parasitárias mais comuns nas feze s (morfologia) a) Protozoários Entamoeba coli : estrutura pequena, cora-se em amarelo claro , arredondada ou ligeiramente ovalada , apresentando 8 núcleos na forma madura . (+ que 4 núcleos já se considera E. coli.) (comensal intestinal) Entamoeba histolytica : estrutura pequena (menor que E. coli ), cora-se em amarelo claro apresentando até 4 núcleos (núcleos maiores que E. coli), Arredondada ou ligeiramente ovalada. (é um parasita facultativo, na luz intestinal ele é comensal, e quando invade o tecido ele é um parasita) Iodamoeba butschilli: Estrutura pequena, arredondada ou ovalada, cora-se em verde claro , apresenta um núcleo pouco visível, e tem como característica diferencial um grande vacúolo corado em roxo. (comensal intestinal) Giardia lamblia: Estrutura muito pequena, ovalada ou arredondada, cora-se em amarelo claro, e normalmente apresenta uma membrana branca. (parasita intestinal e de vias biliares) b) Helmintos Schistosoma mansoni : estrutura muito grande (maior ovo de verme humano), cora-se em marrom claro, e apresenta como característica diferencial um espículo lateral. (parasita do sistema porta-hepático) Hymenolepis nana: Estrutura grande, cora-se em amarelo claro , geralmente arredondada apresentando as estruturas esquematizadas no desenho ao verso. (morfologia lembrando chapéu de mexicano, ou ovo-frito) .(parasita intestinal). Taenia sp : Menor que o ovo de Hymenolepis nana , arredondado, cora-se em âmbar , borda dupla e bem escura. (parasita intestinal) Ancilostomídeo: Estrutura grande, cora-se em amarelo claro, ovalada, apresentando dentro uma única célula, células em divisão ou um embrião. A membrana é simples, bem fina e delicada. (parasita intestinal) Enterobius vermicularis : Estrutura grande , membrana dupla, ovalada, apresentando um lado convexo e o outro reto , em forma da letra ´´D´´. Cora-se em amarelo claro, podendo estar embrionado ou não. (parasita intestinal) Ascaris lumbricoides : Estrutura grande , cora-se em marrom escuro, ovalada ou arredondada, podendo apresentar um revestimento mamilonado (cascudo) ou não. Apresentando membrana dupla. Pode estar fértil ou não. (parasita intestinal) Trichuris trichiura : Estrutura grande , ovalada, apresentando como característica diferencial 2 massas mucóides nos 2 polos do ovo. Podendo estar embrionado ou não. (parasita intestinal)

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 16
5.9.3- Estruturas parasitárias mais comuns nas feze s (morfologia)
Balantidium coli (cisto) Balantidium col (pré-cisto) Balantidum coli (trof.) Giardia lamblia (cisto)
Giardia lamblia (trof) Entamoeba histolytica (cisto) Entamoeba coli (cisto) Isospora belli (oocisto)
Ancilostomídeo (larva rabdt.) Ancilostomídeo (larva filar.) Ancilostomídeo (ovo) Ancilostomideo adulto
Ascaris lumbricoides (ovo) Ascaris lumbricoides (ovo) Enterobius vermicularis (ovo) Strongyloides stercoralis
(larva filarióide)
Strongyloides stercoralis Trichuris trichiura (ovo) Taenia sp (ovo) Hymenolepis nana (ovo) (larva rabdtóide)
Hymenolepis diminuta Schistosoma mansoni Schistosoma mansoni
(ovo) (ovo) (fêmea)

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 17
6- EXAME PARASITOLÓGICO DO SANGUE 6.1- Introdução: Constitui valioso recurso para o diagnostico das doenças parasitárias cujos agentes apresentam formas evolutivas no sangue. 6.2- Importância: Diagnosticar a Malária, a Filariose de Bancroft, as Tripanossomoses e, mais raramente, a Leishmaniose visceral. 6.3- Colheita do sangue: Deve ser realizada na polpa digital do anular esquerdo ou no lóbulo da orelha, onde a pele é fina e tem boa irrigação sanguínea. Caso isto não seja possível, colher o sangue em uma veia e colocá-lo em um frasco com anticoagulante (heparina ou citrato) e quando possível executar os métodos indicados. 6.4- Métodos de Exame: 6.4.1- Exame direto a fresco: Uma pequena gota de sangue colocada no centro de uma lâmina, coberta por uma lamínula e examinada imediatamente (pois a coagulação é rápida) no microscópio, com objetiva 10x e 40x. Caso queira retardar a coagulação, pode-se adicionar uma ou duas gotas de salina. - Visualizar os parasitas vivos (movimentando-se)
6.4.2- Esfregaço Delgado Corado: Uma gota de sangue sem anticoagulante distendida entre duas lâminas e corada pelo Giemsa. Antes de corar, deve secar por agitação vigorosa, para não ocorrer hemólise. Identificar a forma , o gênero e a espécie.
6.4.3- Gota espessa corada: Método de enriquecimento, pois tem muita quantidade de sangue em pequena área da lâmina, logo o parasita pode ser diagnosticado com economia de tempo, mas é difícil a identificação específica. Técnica: 1- Uma grande gota ou quatro gotas de sangue em uma lâmina; 2- Desfibriná-la com um bastão ou estilete e espalhar em 1 cm². 3- Secar a lâmina ao ar ou na estufa a 37 ºC (6 a 36hs) - para fixar; 4- Corar a lâmina pelo Giemsa;

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 18
5- Deixar em repouso por 10 min , lavar e examinar. OBS: Pode-se desmoglobinizar a lâmina em água destilada.
6.4.4- Método de Strout (1962), mod. Por Flores e C ols. (1966) (técnica de concentração) Técnica: 1- Colher 10 a 20 ml de sangue venoso do paciente sem anticoagulante; 2- Após a retração do coagulo, centrifugar o tubo com o sangue à baixa velocidade (1.000 R.P.M.) para retirar os glóbulos; (por 10 minutos) 3- Passar o sobrenadante para um novo tubo e centrifugar a aproximadamente 3.000 R.P.M., para sedimentar os parasitas; (por 10 minutos) 4- Desprezar o sobrenadante e transferir uma gota do sedimento para uma lâmina e realizar um exame direto à fresco; 5- Se positivo o exame direto à fresco, executar um esfregaço delgado corado com o sedimento para identificar a espécie do parasito.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 19
6.5- Estruturas parasitárias do sangue 6.5.1- Doença de chagas Trypanosoma cruzi = forma tripomastigota no sangue periférico
6.5.2- Leishmaniose Visceral (Calazar) Leishmania donovani = forma amastigota no aspirado de medula óssea
6.5.3- Filariose (Elefantíase) Wuchereia bancrofti = microfilária no sangue periférico

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 20
6.5.4- Malária Plasmodium falciparum
Plasmodium vivax
Plasmodium malariae

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 21
7- EXAME PARASITOLÓGICO DAS SECREÇÕES 7.1- Finalidade: Diagnosticar a tricomonose urogenital (Trichomonas vaginalis). 7.2- Coleta do material: Usar um swab estéril embebido em solução fisiológica também estéril e coletar a secreção. 7.3- Métodos de exame: 7.3.1- Exame direto a fresco: - Transferir o material colhido do swab para uma lamina, colocar uma gota de solução fisiológica, uma lamínula e observar em microscópio com objetiva 10x e 40x. Resultado: Positivo para Trichomonas sp.
7.3.2- Método de concentração: 1- Colocar o swab com o material colhido em um tubo de ensaio contendo aproximadamente 5 ml de solução fisiológica e incubar a 37 ºC por 30 minutos; 2- Centrifugar o tubo com o material a aproximadamente 3.000 r.p.m. por 5 a 10 minutos, desprezar o sobrenadante e colocar uma gota de sedimento entre lâmina e lamínula (exame direto a fresco). Resultado: Positivo para Trichomonas sp.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 22
7.3.3- Exame do sedimento urinário: 1- Centrifugar o tubo com 5 ml de urina do paciente a aproximadamente 3.000 r.p.m. por 5 a 10 minutos; 2- Desprezar o sobrenadante e colocar uma gota dói sedimento entre lâmina e lamínula (exame direto a fresco). Resultado: Positivo para Trichomonas sp.
7.3.4- Coloração pelo Shorr ou Papanicolau 1- Material colhido pelo ginecologista, transferido para uma lâmina e fixado; 2- Corado pelo laboratório (Shorr ou Papanicolau) e observado em microscopia com objetiva 40x.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 23
8 – BREVE RESUMO DAS PARASITOSES MAIS COMUNS NO BRA SIL A) Protozooses: Doenças causadas por protozoários: 1- Amebíase: Doença intestinal provocada pela ameba chamada Entamoeba histolytica Sua transmissão é através da ingestão do cisto maduro de Entamoeba histolytica por água ou alimento contaminado, insetos vetores ou contato direto. Esta doença provoca destruição (ulcerações) do intestino e pode migrar para outros órgãos (Fígado, pulmões, S.N.C. e etc) formando abscessos amebianos necróticos. É caracterizado pela disenteria com presença de muco e sangue, febre, dor abdominal, nervosismo e debilidade geral. Pode ser evitada com saneamento básico, educação sanitária, higiene alimentar, higiene pessoal e tratamento dos portadores. 2- Giardíase: Doença intestinal e de vias biliares muito comuns em crianças em idade escolares, provocadas pelo flagelado chamado Giardia lamblia. Sua transmissão é através da ingestão do cisto maduro de Giardia lamblia por água ou alimento contaminado, insetos vetores ou contato direto, ela provoca alterações digestivas (dificuldade na digestão de gorduras e vitaminas A, K, D e E). O hospedeiro pode apresentar diarréias transitórias, náuseas, falta de concentração, insônia, irritabilidade, dor do lado direito (hipocôndrio), perda de peso e até convulsões. Pode ser evitada com saneamento básico, educação sanitária, higiene alimentar, higiene pessoal e tratamento dos portadores. 3- Doença de Chagas: Doença descoberta pelo sanitarista brasileiro Carlos Chagas, tem por agente etiológico um flagelado chamado Trypanosoma cruzi e como vetor biológico um inseto (hemíptero) conhecido popularmente por “bicho barbeiro” ou Chupão (Triatoma) que elimina o parasita nas suas fezes. È uma doença americana de evolução lenta, normalmente sem sintomas mas que pode evoluir para a destruição do coração, do esôfago, do cólon e do S.N.C. Pode-se evitar combatendo o inseto, melhorando as habitações (casas de alvenaria), e examinando o sangue de doadores. 4- Leishmanioses: 3 tipos. a) Leishmaniose Tegumentar Americana (LTA) – Leishmania braziliensis. Acomete o homem e diversos animais, é uma enfermidade da pele e das mucosas. Provoca lesões ulcerosas indolores na pele, lesões mucosas agressivas nas regiões naso-faríngeas e formas difusas com lesões nodulares não ulceradas. b) Leishmaniose Tegumentar do Velho Mundo (botão do Oriente) – Leishmania tropica. Provoca úlceras indolores (não existe no Brasil). c) Leishmaniose Visceral Americana (Calazar) – Leishmania donovani. Doença crônica, generalizada acometendo principalmente o baço, o fígado e a medula óssea. Caracteriza-se por febre, hepato-esplenomegalia, anemia, caquexia, edema e óbito. As Leishmanioses são transmitidas do Brasil pela picada de mosquitos fêmeas do gênero Luizomyia (biriqui, mosquito palha). Para se evitar as Leishmanioses deve-se combater o mosquito vetor com inseticidas, construir as casas a pelo menos 500 metros da mata, uso de repelentes e mosquiteiro. 5- Toxoplasmose: Esta zoonose (doença de animais e homens) tem grande incidência mundial, o agente é o esporozoário chamado Toxoplasma gondii, que pode ser transmitido por contato direto

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 24
(taquizoito), pela ingestão de carne crua ou mal passada (bradizoito) ou por alimentos contaminados com as fezes dos felinos como o gato (oocisto). A doença geralmente é assintomática e de pouca importância em adultos normais (sendo grave em indivíduos adultos com AIDS – forma meningo-encefalica), porém a forma congênita é muito grave podendo destruir o S.N.C. e o olho do embrião, levando ao aborto, retardamento mental, calcificações cerebrais, hidro e microcefalia, corio-retinite e natimorto (Síndrome de Sabin). Esta doença pode ser evitada diminuindo a promiscuidade com animais domésticos, diminuindo o Nº. de parceiros sexuais, usando preservativos, examinando o sangue doado, evitando ingerir carnes cruas ou mal passadas, leite cru, e ovo cru, alem das medidas de higiene preconizadas para as outras parasitoses. 6- Malaria: Esta parasitose já causou danos a milhões de pessoas no mundo, tem por agentes no Brasil o Plasmodium vivax , Plasmodium falciparum e o P. malariae e na África também o P. ovale. Sua transmissão ocorre pela picada do mosquito fêmea do Gênero Anopheles. O agente da malaria ataca o fígado, provoca destruição das hemácias (leva a anemia), o hospedeiro fica incapacitado para o trabalho uma vez que apresenta acessos de febre cíclicos (frio-calor-sudorese) e a temperatura chega a 41 ºC. A doença pode ser evitada pelo combate ao inseto vetor com inseticidas, exames nos doadores de sangue, uso de repelentes, uso de mosquiteiros e a vacinação (em fase de estudo ainda). 7- Isosporose : Doença intestinal provocada pelo Isospora belli. Ocorre pela ingestão de oocistos maduros do Isospora belli através de água e alimentos contaminados com as fezes humanas. Na maioria das vezes a infecção é assintomática. Se sintomática irá causar a febre, diarréia, cólica, vômitos, anorexia, cefaléia, alteração de mucosa do intestino delgado levando a má absorção. Essa doença pode ser evitada mantendo boa higiene pessoal, higiene alimentar, saneamento básico e tratamento dos portadores. 8- Tricomonose urogenital: A tricomonose é uma doença venérea e é transmitida através de relação sexual. O Trichomonas vaginalis habita o trato geniturinário do homem e da mulher, onde produz a infecção, não sobrevivendo fora do sistema urogenital. Nas mulheres, a doença pode começar com uma secreção espumosa de cor verde-amarelada e odor desagradável, proveniente da vagina. Os homens com tricomoníase não manifestam habitualmente sintomas, mas podem infectar as suas parceiras sexuais. Alguns apresentam uma secreção proveniente da uretra, espumosa e semelhante ao pus, sentem dor ao urinar e polaciúria. Evita-se a transmissão do parasita causador da doença praticando o sexo seguro, ou seja, pela adequada higiene genital, diminuindo-se o número de parceiros sexuais e usando-se preservativos. Tanto o preservativo masculino quanto o feminino provaram-se eficaz em reduzir as chances de contaminação. B) Helmintíases ou Verminoses: Doenças provocadas por Vermes ou Helmintos. 1- Esquistossomose Mansônica ou “Barriga D’agua” ou Xistose ou mal do caramujo: Verminose provocada pelo Schistosoma mansoni, verme achatado não segmentado (Platyhelminthes da classe trematoda) com dimorfismo sexual que lança seus ovos pelas fezes do homem e no meio ambiente aquático contamina o caramujo (planorbídeo) gerando a cercaria que penetra na pele do homem que tem contato com a água contaminada. O parasita na fase adulta vive nas veias do sistema porta-hepático do homem e os seus ovos retidos no tecido causam sérios problemas no fígado e intestino (granulomas). Os sintomas são diarréia muco-sanquinolenta, dor abdominal, hepatomegalia, ascite (barriga d’água), esplenomegalia, circulação

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 25
colateral, varizes esofagianas e hemorragias. Previne-se a doença destinando-se adequadamente os dejetos humanos, evitando banhar-se em lagoas nas regiões endêmicas, usando proteção nos pés e pernas para o trabalho em locais alagados e combatendo os caramujos (Gênero Biomphalaria) 2-Teniase : Verminose provocada pela solitária do porco Taenia solium e pela solitária do boi Taenia saginata. As taenias são os maiores vermes do homem, seu tamanho pode variar de 2 a 6 metros, morfologicamente são vermes achatados e segmentados (Platyhelminthes da Classe Cestoda) e hermafroditas. A transmissão ocorre pela ingestão via oral de carne crua ou mal passada contaminada com cisticerco (Larva da Taenia). O verme se instala no intestino e espolia intensamente o hospedeiro. Os sintomas são apetite excessivo, náuseas, vômitos, dores abdominais, tonturas e astenia. Evita-se a doença cozinhando bem as carnes de bovinos e suínos. 3- Cisticercose humana: Mais grave que a teníase, a Cisticercose é a instalação no homem da larva da Taenia solium o Cysticercus cellulosae que cresce comprimindo os tecidos ao seu redor. A transmissão ocorre quando o homem faz o papel do hospedeiro intermediário e ingere o ovo de T. solium. Dependendo da localização, o cisticerco pode levar a conseqüências muito graves (neurocisticercose , cisticercose ocular, e cisticercose muscular). Evita-se a cisticercose tratando-se os doentes de teníase, destinando-se adequadamente os dejetos humanos além das medidas higiênicas pessoais e alimentar. 4- Himenolepíase : A himenolepíase é uma infecção intestinal causada por uma taenia (Hymenolepis nana) que varia de 3 a 4 cm. Ela é transmitida pela da ingestão de ovos de Hymenolepis nana através de água ou alimentos contaminados com fezes infectadas. Pode ocorrer também através da mão contaminada pelas fezes (transmissão pessoa-a-pessoa). Os insetos, carunchos de cereais infectados podem ser ingeridos acidentalmente, resultando na transmissão do agente. As infecções leves podem ser assintomáticas. Se a infecção for severa pode causar enterites como diarréia, dor abdominal e outros sintomas, como palidez, perda de peso e debilidade. A himenolepíase pode ser evitada através de higiene pessoal, higiene alimnetar , saneamento básico, combate aos roedores e carunchos de cereais e tratamento dos portadores. 5- Ascaridíase: O Ascaris lumbricoides (“lombriga”) é o campeão brasileiro das verminoses, é a um verme intestinal cilíndrico (Aschelminthes da classe Nematoda), que se transmite pela via oral através da ingestão de ovos com água ou alimentos contaminados. É o segundo maior verme do homem e o maior entre os vermes cilíndricos (20 a 30 cm de comprimento com dimorfismo sexual). Sua patogenia inicia-se nos pulmões com a migração das larvas (ciclo de Looss), no intestino o verme adulto espolia, intoxica e pode irritar e obstruir o intestino ou outros órgãos por migração. Os sintomas são a desnutrição e depauperamento físico e mental. A ascaridíase pode ser evitada com as medidas de higiene alimentar, saneamento básico e tratamento dos portadores. 6- Enterobíase ou oxiuriase: O Enterobius vermicularis (Oxiurús ou “largatinha”) é um Aschelminthes da classe Nematoda como a “lombriga”, vive no ceco e apêndice e são muito pequenos (5 a 7 mm). Sua transmissão é via oral através da ingestão de ovos com água ou alimentos, mas principalmente através das mãos (as unhas das crianças ficam repletas de ovos após coçar a região anal). Na maioria dos casos a parasitose passa despercebida pelo

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 26
hospedeiro, porém é comum ele provocar enterite catarral, um intenso prurido anal noturno e continuado lesando a pele e podendo adquirir infecções bacterianas secundárias. Evita-se esta parasitose com as mesmas medidas citadas para a ascaridíase, além do corte rente das unhas das crianças. 7- Tricuríase: A Tricuríase ou Tricuriose é uma parasitose intestinal causada pelo nematódeo Trichuris trichiura, que se transmite por via oral através da ingestão de ovos com água ou alimentos contaminados. Esta infecção é cosmopolita, quase sempre sua prevalência segue paralelamente a do Ascaris lumbricoides, devido ser idêntico o modo de transmissão. a doença é assintomática, porém se for elevada pode ocorrer extensa necrose da mucosa intestinal com hemorragias e diarréia sanguinolenta, podendo progredir para anemia por déficit de ferro. Outros sintomas são a dor abdominal, perda de peso em indivíduos já desnutridos, flatulência e fadiga. Em casos incomuns pode ocorrer apendicite (se o verme entrar no apêndice e não conseguir sair) e prolapso retal com hemorróidas. A tricuríase pode ser evitada com as medidas de higiene alimentar, saneamento básico e tratamento dos portadores. 8- Ancilostomose ou Amarelão: A doença do “Jeca”(Monteiro Lobato) tem dois agentes no homem, o Ancylostoma duodenale e o Necator americanus. São vermes pequenos (5 a 11 mm), cilíndricos como o oxiúrus, e de habitat intestinal. A transmissão ocorre por penetração ativa de larvas filarióides pela pele e mucosas ou pela ingestão via oral destas mesmas larvas. O parasita no intestino traumatiza a mucosa com sua peças bucais (4 dentes no Ancylostoma e 2 placas cortantes no necator) e espolia sangue levando a um quadro de anemia, palidez, geofagia (habito de comer terra), desnutrição e fraqueza. Evita-se com saneamento básico, higiene pessoal, alimentar , tratamento dos portadores e uso de calçados em áreas endêmicas. 9- Estrongiloidíase : Doença parasitária intestinal causada pelo nematódeo Strongyloides stercoralis, freqüentemente assintomática. As formas sintomáticas apresentam inicialmente alterações cutâneas, secundárias à penetração ativa das larvas infectantes na pele (forma de trasmissão) e caracterizadas por lesões urticariformes. A migração da larva pode causar manifestações pulmonares, como tosse seca, dispnéia ou broncoespasmo e edema pulmonar (Síndrome de Löeffer). As manifestações intestinais podem ser de média ou grande intensidade, com diarréia, dor abdominal e flatulência, acompanhada ou não de anorexia, náusea, vômitos. Evita-se com saneamento básico, tratamento dos portadores e principalmente pelo uso de calçados em áreas endêmicas. 10- Filariose de bancroft : A filariose ou elefantíase é a doença causada pelo parasita nematódeo Wuchereria bancrofti, comumente chamados filária, Esta doença é também conhecida como elefantíase.Tem como transmissor os mosquitos dos gêneros Culex. Os episódios de transmissão de microfilárias (geralmente à noite) pelos vasos sanguíneos podem levar a reações do sistema imunológico, como prurido, febre, mal estar, tosse, asma, fadiga, inchaço dos gânglios linfáticos e com inchaços nos membros, escroto ou mamas. Por vezes causa inflamação dos testículos. Em longo prazo, a presença de vários pares de adultos nos vasos linfáticos, com fibrosação e obstrução dos vasos (formando nódulos palpáveis) pode levar a acumulações de linfa a montante das obstruções, com dilatação de vasos linfáticos alternativos e espessamento da pele. Esta condição manifesta-se como aumento de volume grotesco das regiões afetadas. Para se evitar é útil usar roupas que cubram o máximo possível da pele, repelentes de insetos e dormir protegido com redes.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 27
Pesquisa de Sangue Oculto nas Fezes 1- Introdução: A pesquisa de sangue oculto é de grande importância clinica no diagnostico das hemorragias do trato digestivo, tendo por base os efeitos catalíticos dos compostos de heme sobre a oxidação de substâncias orgânicas como a benzidina, guáiaco e outras. - Dos produtos de desdobramento de hemoglobina, somente a hematina possui a atividade de peroxidase, como também, a mioglobina e algumas enzimas vegetais. - Assim, o sangramento gengival, epistaxes e a alimentação podem influir no resultado de um exame, dada a grande sensibilidade das provas. A cor das fezes pode orientar sugestivamente, mas não de modo absoluto. É normal o homem perder de 1 a 3 ml de sangue nas fezes por dia. � Dejeção negra ou semelhante a borra de café (Melena), indica hemorragia alta, gástrica ou duodenal, quando superior a 50ml de sangue. , Causas : úlcera gástrica (não é constante), câncer gástrico (constante) , medicamento (AAS) irrita mucosas. � Fezes de aspecto normal e coradas de Vermelho-Rutil ante, supõe-se sangramento hemorroidário, sem excluir lesões de cólon ou pontos mais distantes. 2- Colheita de fezes: É indispensável que a colheita de fezes para pesquisa de sangue oculto seja bem feita, ara que os resultados obtidos tenham significação clínica. - Pessoas normais perdem até três ml de sangue por dia nas fezes, devido a pequenas escoriações em mucosas, boca, nasofaringe, trato gastrintestinal (gástrico ou duodenal), que se ultrapassar a 50ml as fezes fica enegrecida. (Melena). - A própria presença de melena não indica hemorragia ativa, atual - Uma única hemorragia pequena no estomago pode resultar em fezes escuras. � Recomendações para a Colheita das Fezes: Durante 4 dias o paciente deve evitar . Comer carnes, rabanete, nabo, couve-flor e brócolis; . Consumo de certos medicamentos: antiinflamatórios, corticóides, aas, compostos de ferro e vitamina C ; . Não contaminar as fezes com urina;. . Colher em um frasco quimicamente limpo e seco, as fezes devem ser recentes, aproximadamente 20 a 30 gramas e sem preservativos. 3- Técnicas de exame: - Provas de Peroxidase 1- Reação de Meyer. 2- Reação de Guáiaco 3- Reação da Benzidina Reação de Meyer: Fundamento: A fenolftaleína é reduzida pelo zinco para anidrido ftálico que, oxidado pela água oxigenada, desprende oxigênio pela ação do sangue, transforma-se novamente em fenolftaleína, assumindo cor vermelha no meio alcalino. Reativo de Meyer-Johannessen: Fenolftaleína........................................2 g. Hidróxido de Potássio anidro.............20 g. Água destilada q.s.p.......................100 ml.

Professor: Rafael Ramos Lages Bento – Biomédico – FASI 28
- Aquecer até a fervura, acrescentando 10 a 30 g de zinco em pó para a obtenção de descoloração completa. - Filtrar e guardar em frasco âmbar, com um pouco de zinco em pó no fundo do frasco. Metódica: Diluir as fezes à aproximadamente 5%, com água destilada; Filtrar em gaze (peneira) , ou centrifugar e usar o sobrenadante; - Passar 5 ml para um tubo de ensaio e juntar 1 ml do reativo Meyer-Johannessen - Inverter várias vezes e acresentar 3 a 4 gotas de Peróxido de hidrogênio (H2O2). Resultado: A positividade da reação é considerada, quando dese nvolve-se coloração vermelha imediata. Negativo: não há desenvolvimento de cor. Bibliografia : NEVES, David Pereira...[et al.]. Parasitologia humana. 10. Ed. São Paulo: Atheneu, 2003. DE CARLI, Geraldo Attilio. Parasitologia clínica: seleção de métodos e técnicas de laboratório para o diagnóstico das parasitoses humanas. São Paulo: Atheneu, 2001. CIMERMAN, Benjamin; CIMERMAN, Sérgio. Parasitologia humana e seus fundamentos gerais. 2. ed. São Paulo: Atheneu, 2006. NEVES, David Pereira; BITTENCOURT NETO, João Batista. Atlas didático de parasitologia. São Paulo: Atheneu, 2006. REY, Luís. Bases da parasitologia médica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2002. GASPARINI, Eduardo Antônio. PORTELLA, Renata. Manual de Parasitoses intestinais. Rio de Janeiro: Rubio, 2005. NEVES, David Pereira...[et al.]. Parasitologia humana. 11. Ed. São Paulo: Atheneu, 2005.